Атомные орбитали. Законы расположения электронов в атоме.
Атомные орбитали. Законы расположения электронов в атоме.
Электронный паспорт элемента(по-моему так)
Атомное ядро состоит из протонов – положительно заряженных частиц и нейтронов – частиц, не имеющих заряда.
Согласно квантовой теории строения атома, все электроны в атоме движутся по энергетическим уровням или орбитам. Эти уровни состоят из подуровней. В свою очередь подуровни состоят из атомных орбиталей.
Электронные орбиты в модели Бора обозначаются целыми числами:1, 2, 3, 4,… и так до n, или латинскими буквами по алфавиту, начиная с буквы K, L, M, N, O P, Q. Начиная от ближайшего к ядру уровня.
Уровни в свою очередь состоят из подуровней. Число подуровней на каждом уровне равно номеру уровня. Подуровни имеют названия.
1ый подуровень каждого уровня называется S,
2-ой подуровень каждого уровня называется P,
3-ий подуровень каждого уровня называется d,
4-ий подуровень каждого уровня называется f
Атомная орбиталь (АО) - область наиболее вероятного пребывания электрона (электронное облако) в электрическом поле ядра атома.
Положение элемента в Периодической системе определяет тип орбиталей его атомов (s-, p-, d-, f-АО и т.д.), различающихся энергией, формой, размерами и пространственной направленностью.
Для элементов 1-го периода (Н, He) характерна одна АО - 1s.
В элементах 2-го периода электроны занимают пять АО на двух энергетических уровнях: первый уровень 1s; второй уровень - 2s, 2px, 2py, 2pz. (цифры обозначают номер энергетического уровня, буквы - форму орбитали).
Законы
1.Любая частица стремится к минимальному запасу потенциальной энергии.
2. Запрет Паули. В атоме не может быть двух электронов, имеющих одинаковые значения всех четырёх квантовых чисел. Запрет Паули определяет электронную ёмкость орбиталей, подуровней и уровней. Электронная ёмкость уровней рассчитывается по формуле: N = 2n2, где N – число электронов на данном уровне, n – главное квантовое число.
3. Принцип Хунда. На данном энергетическом подуровне электроны располагаются таким образом, чтобы модуль их суммарного спина был максимальным.
4. Первый закон Клечковского. Электронами в первую очередь заполняются орбитали с меньшим значением суммы главного и орбитального чисел, а затем уже орбитали с большим значением суммы этих двух чисел. Согласно первому закону Клечковского, в первую очередь заполняются электронами ns-орбитали, а затем (n-1)d, которые имеют больший запас потенциальной энергии.
5. Второй закон Клечковского. Если две орбитали имеют одинаковое значение суммы главного и орбитального чисел, то в первую очередь электронами заполняется та орбиталь, у которой главное квантовое число имеет меньшее значение.
электронный паспорт атома водорода выглядит следующим образом: 1s1.
аналитический электронный паспорт атома меди. Он будет выглядеть вот так: 1s22s22p63s23p63d104s1
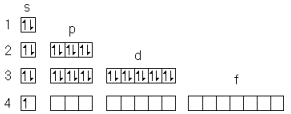
графический электронный паспорт атома меди.
2) степень гидролиза
Обменная реакция между водой и соединением называется гидролизом.
Гидролиз солей - взаимодействие в водных растворах катионов и (или) анионов солей с молекулами воды, при котором к катиону, оказавшемуся в растворе, присоединяется группа ОН- , а к аниону - ион Н+ молекулы воды.
В результате гидролиза в растворе появляются ионы Н+ и ОН-, и среда становится соответственно кислой или щелочной.
Возможны следующие случаи гидролиза солей:
1) по аниону,
2)катиону,
3) катиону и аниону одновременно.
Na2S + H2SO4(конц) ---> Na2SO4 + H2S
эта реакция не является окислительно-восстановительной!
Это реакция ионного обмена
----------------------------------------------------------------------------------------------------------------------
1.Корпоскулярно-волновая теория. Принцип неопределенности. Теория Бора.
Диссоциация воды
Вода диссоциирует на ионы: H2O ↔ H+ + OH-
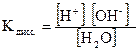 или
или 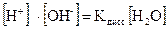
Поскольку степень диссоциации воды очень мала, то концентрация воды практически постоянна:
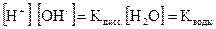 , эта величина носит название ионного произведения воды.
, эта величина носит название ионного произведения воды.
При 250С 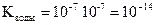
Растворы, где концентрации водородных и гидроксид-ионов одинаковы, нейтральны:
Для удобства вычислений пользуются не концентрацией водородных ионов, а водородным показателем (pH):
pH = - lg [H+], соответственно:
pH = 7 нейтральная среда;
pH ‹ 7 кислая среда;
pH › 7 щелочная среда.
--------------------------------------------------------------------------------------------------------------------------
1. вода, агрегатные состояния воды, водородные связи
Вода H2O – это оксид водорода , в котором водород проявляет степень окисления +1, а O-2
Молекула воды полярна и имеет угловую форму. Молекула воды взаимодействует между собой, образуя водородную связь. Это обуславливает аномалию температур плавления и кипения - они значительно выше, чем у ее химических аналогов.
Физические свойста:
Чистая вода не имеет цвета, вкуса и запаха, толстые слои воды (более 5 м) имеют голубую окраску. Затвердевание воды в лёд сопровождается увеличением объёма на 9%, то есть лёд легче жидкой воды (вторая аномалия воды). T кип = +100,0 °C Наибольшую плотность вода имеет не при 0 °C, а при 4 °C (третья аномалия воды).
Сущ-ет в 3 агрегатных состояниях: тв.- лед, жидкое и газообразное – водяной пар.
Химические свойства:
Вода - чрезвычайно слабый электролит (H2O <—> Н+ + ОН−), электропроводность чистой (дистиллированной) воды весьма мала, поэтому электролиз воды проводят в присутствии сильных электролитов.
По химическим свойствам вода - достаточно активное вещество, в подходящих условиях она реагирует со многими металлами и неметаллами, основными и кислотными оксидами:
2H2О + 2Na = 2NaOH + H2↑ H2O + BaO = Ba(OH)2
H2O + Cl2 = HClO + HCl 3H2O + P2O5 = 2H3PO4
- Благодаря полярности молекул воды в ней растворяются и диссоциируют основания, кислоты и соли, большинство солей вступает с водой в реакции обратимого гидролиза.
- Вода как растворитель способствует протеканию огромного количества обменных и окислительно-восстановительных реакций.
- Со многими безводными солям вода образует кристаллогидраты ( белого сульфата меди(II) CuSO4 в голубой медный купорос CuSO4 . 5H2O).
Энергия Гиббса
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж):
|
Характер этого изменения позволяет судить о принципиальной возможности или невозможности осуществления процесса.
Дисперсные системы
Диспе́рсная систе́ма — это образования из двух или большего числа фаз (тел), которые практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
Обычно дисперсные системы — это коллоидные растворы, золи. К дисперсным системам относят также случай твёрдой дисперсной среды, в которой находится дисперсная фаза.
Наиболее общая классификация дисперсных систем основана на различии в агрегатном состоянии дисперсионной среды и дисперсной фазы. Сочетания трех видов агрегатного состояния позволяют выделить девять видов дисперсных систем. Для краткости записи их принято обозначать дробью, числитель которой указывает на дисперсную фазу, а знаменатель на дисперсионную среду, например для системы «газ в жидкости» принято обозначение Г/Ж.
Примером сложной дисперсной системы может служить молоко, основными составными частями которого (не считая воды) являются жир, казеин и молочный сахар. Жир находится в виде эмульсии и при стоянии молока постепенно поднимается кверху (сливки). Казеин содержится в виде коллоидного раствора и самопроизвольно не выделяется, но легко может быть осаждён (в виде творога) при подкислении молока, наприм., уксусом. В естественных условиях выделение казеина происходит при скисании молока. Наконец, молочный сахар находится в виде молекулярного раствора и выделяется лишь при испарении воды.
2.ионное произведение воды, ph
3.гидролиз какой-то
--------------------------------------------------------------------------------------------------------------------------
Билет 4
1) Потенциал ионизации, радиус атома, сродство к электрону.
Ионизация – это удаление электрона из свободного атома или молекулы в газе. (Только неупругие столкновения приводят к ионизации). Энергия, которая должна быть сообщена электрону для его ионизации, называют потенциалом ионизации.
Потенциал ионизации. – это энергия, затраченная в вакууме на удаление электрона из атома на бесконечно большое расстояние. Ме = Меn+ + е + I . (+) соответствует затрате энергии извне – система энергию получает.
Измеряется в электрон-вольтах или кДж. 1 эВ = 1.6 10-19Дж.
Например: IСа= 6,11 эВ. Чем меньше потенциал ионизации, тем легче электрон оторвать от атома. Легче всего удалить первый электрон, затем второй и т.д., поэтому I1 < I2 < I3. Фактически, П.И. – это мера степени металлических свойств элемента. Чем меньше П.И., тем сильнее выражены металлические свойства атома.
В группе придвижении сверху вниз (с увеличением порядкового номера) наблюдается уменьшение П.И., что связано с увеличением атомных радиусов, большим расстоянием до ядра и. соответственно, меньшим притяжением к ядру. В периоде с увеличением порядкового номера – в основном, постепенное увеличение П.И., связанное с ростом заряда ядра и, соответственно с большим притяжением электронов к ядру. Однако есть исключения, связанные с особенностями электронной структуры атомов.
Радиусом атома- называется расстояние между атомным ядром и самой дальней из стабильных орбит электронов в электронной оболочке этого атома.
Значения атомных радиусов элементов находятся в периодической зависимости от атомного номера элемента. В периоде при движении слева направо наблюдается уменьшение атомных радиусов, т.к. увеличивается притяжение электронов к ядру, несмотря на силы отталкивания между электронами, количество которых увеличивается. При движении в группах сверху вниз имеет место увеличение атомных радиусов из-за увеличения числа электронных слоев атома. Радиусы катионов меньше, а радиусы анионов больше, чем радиусы атомов.
СРОДСТВО к ЭЛЕКТРОНУ (Е).
Сродство к электрону – энергия, которая выделяется в результате присоединения электрона к атому: Э + е = Эn+ -
Наибольшим сродством к электрону обладают р-элементы VII группы, т.к. они приобретают конфигурацию s2р6 – инертных газов.
Наименьшим и даже отрицательным – атомы с конфигурацией s2р6 (инертные газы), т.е. они фактически отталкивают электрон от атома. Водород может не только терять электрон, но и приобретать. Но сродства к электрону водорода в 20 раз меньше, чем потенциал ионизации. Поэтому, в основном атом водорода образует положительно заряженные ионы Н+, а не Н-.
2) Растворы. Законы Рауля.
Раствор — гомогенная физико–химическая система переменного состава, состоящая из двух или более компонентов и продуктов их взаимодействия.
По агрегатному состоянию растворы разделяют на жидкие, твердые и газообразные (рис.1). Наиболее значительную роль в химии и особенно в биохимии играют жидкие растворы.
Компонентами раствора являются растворитель (среда) и растворенное вещество, равномерно распределенное в растворителе в виде молекул или ионов. Под растворителем обычно понимают то вещество, которое находится в таком же агрегатном состоянии, как и раствор в целом. Если вещества, составляющие раствор, имеют одинаковое агрегатное состояние (например, спирт и вода), то растворителем называют то из веществ, которое имеется в большем количестве.
Первый закон Рауля
Над каждой жидкостью (растворителем или раствором) устанавливается определенное давление пара, насыщающего пространство. Это давление характеризует состояние равновесия между жидкой фазой и находящимися над нею молекулами растворителя.
Согласно Первому закону Рауля относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
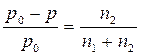 или
или 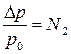 ,
,
где n2– количество растворенного вещества
n1- количество вещества растворителя.
p0-давление пара растворителя , p -давление пара раствора
Второй закон Рауля
Наряду с понижением давления пара изменяются также температуры кипения и замерзания указанных растворов. Растворы кипят при более высокой температуре, а замерзают – при более низкой, по сравнению с соответствующими температурами для чистого растворителя.
Повышение температуры кипения одномоляльного раствора называется эбулиоскопической постоянной растворителя Екип, а понижение температуры замерзания – криоскопической постоянной растворителя Езам. Таким образом, в соответствии со вторым законом Рауля повышение температуры кипения или понижение температуры замерзания разбавленных растворов неэлектролитов пропорциональны числу частиц растворенного вещества и не зависят от его природы:
Dtкип = Екип · m,
Dtзам = Езам · m;
где Екип и Езам – коэффициенты пропорциональности, соответственно - эбулиоскопическая и криоскопическая константы, зависящие только от природы растворителя. Для воды Езам = 1,86; Екип = 0,516; m – моляльность раствора.
3) CI2+I2+H20 = (ОВР)
5Cl2 + I2 + 6H2O = 10HCl + 2HIO3
Cl2(0) +2e- --> 2Cl(-1) 5 процесс восстановления, Cl окисл-ль
I2(0) -10e- ----> 2I(+5) 1 процесс окисления, I восстановитель
--------------------------------------------------------------------------------------------------------------------------
1) Понятие валентности и естественное окисление элемента. Основные классификации неорганических соединений.
2) Произведение растворимости.
3)Написать продукты реакции: Na2S+ZnSO4=(эта реакция обмена)
ZnSO4 + Na2S=Na2SO4+ZnS
Zn^(2+) + SO4^(2-) + 2Na^(+) + S^(2-) = 2Na^(+) + SO4^(2-) + ZnS
Zn^(2+) + S^(2-) = ZnS
--------------------------------------------------------------------------------------------------------------------------
Билет 12:
1) ОВР: ZN+H2SO4(конц.)
3Zn+4H2SO4(конц)=3ZnSO4+S+4H2O
Zn(0)-2e=Zn(+2)|3 окисление
S(+6)+6e=S(0) |1 восстановление
Катализ.
Катализ — процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Каталитические реакции — реакции, протекающие в присутствии катализаторов.
Катализомназывается изменение скорости химической реакции под действием веществ, химический состав и количество которых в результате реакции остаются неизменными. Эти вещества получили название катализаторов.
Скорость химической реакции в присутствии катализаторов может увеличиваться или уменьшаться. В первом случае говорят о положительном, во втором — об отрицательном катализе. Отрицательный катализ часто называют ингибированием, а вещества, вызвавшие его, — ингибиторами.
Различают гомогенный и гетерогенный катализ. При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу. При гетерогенном катализе катализатор находится в системе в виде самостоятельной фазы, отделенной от других частей системы поверхностью раздела.
Пример гомогенного катализа: разложение растворенного в воде пероксида водорода присутствии находящихся в том же растворе иодид-ионов. Здесь реагирующие вещества и катализатор образуют однородную систему без границы раздела.
H2O2 + I- → IO- + H2O
H2O2 + IO- → H2O + O2 ↑ +I-
2H2O2 + I- → 2 H2O + I- +O2↑
Катализ широко используется в химической промышленности и в смежных с ней отраслях, так как это способствует резкому повышению производительности технологических процессов.
Иногда оказывается желательным замедлить химические реакции, и тогда в системы вводят ингибиторы. Например, с помощью специально подобранных ингибиторов замедляют окислительные процессы в смазочных маслах, пищевых жирах, дизельном топливе, полимеризацию и старение полимеров.
3. Что будет при смешивании сульфида алюминия с ацетатом калия(натрия? кальция?)
При смешивании растворов сульфата алюминияAl2S3 и сульфида калияCH3COOK выпадает осадок белого цвета - гидроксид алюминия. Укажите причину этого явления и составьте молекулярные и сокращенно-ионные уравнения сокращенных процессов.
Гидролиз образовавшегося Al2S3
Аl2S3 + 6HOH =>2Аl(ОН) 3 + 3Н2S
2Al3+ + 3S2- + 6H+ + 6OH- =>2Аl(ОН) 3 + 6Н+ + S2-
рН =7
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота:
Al2S3 + 6H2O = 2Al(OH)3↓ + H2S↑
Гидролиз ацетата калия - CH3COOK
CH3COOK – соль сильного основания и слабой кислоты, поэтому гидролиз протекает по аниону.
Молекулярное уравнение:
CH3COOK + HOH ⇄ CH3COOH + KOH
Полное ионное уравнение:
CH3COO- + K+ + HOH ⇄ CH3COOH + K+ + OH-
Краткое ионное уравнение:
CH3COO- + HOH ⇄ CH3COOH + OH-
Т.к. в результате гидролиза образовались гидроксид-ионы (OH-), то раствор имеет щелочную среду (pH > 7
--------------------------------------------------------------------------------------------------------------------------
Энтальпия
Энтальпия — это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре. Это значит, что, хотя вещество может обладать энергией на основании температуры и давления, не всю ее можно преобразовать в теплоту. Часть внутренней энергии всегда остается в веществе и поддерживает его молекулярную структуру. Часть кинетической энергии вещества недоступна, когда его температура приближается к температуре окружающей среды. Следовательно, энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении. Единицы энтальпии — британская тепловая единица или джоуль для энергии и Btu/lbm или Дж/кг для удельной энергии.
Второй закон термодинамики
Этот закон утверждает, что все самопроизвольно протекающие процессы обязательно сопровождаются увеличением суммарной энтропии системы и ее окружения. Второй закон термодинамики, возможно, является одним из наиболее общих положений всей науки в целом. Существует много различных формулировок этого закона. Но главная мысль всех этих формулировок заключается в том, что в любой изолированной системе с течением времени происходит постоянное возрастание степени беспорядка, т.е. энтропии.
Третий закон термодинамике утверждает, что энтропия идеального ионного кристалла при температуре абсолютного нуля (0 К) равна нулю.
2. Хлорокислородные кислоты.
Хлор образует ряд кислородных кислот —
HClO - хлорноватистую ,
HClO2 - хлористую,
HClO3 - хлорноватую
и HClO4 - хлорную.
Эти кислоты и их соли — гипохлориты, хлориты, хлораты и перхлораты— являются сильными окислителями.
Активность кислородных кислот хлора возрастает от хлорноватистой к хлорной кислоте. Окислительная их активность увеличивается в обратном порядке — от хлорной к хлорноватистой, которая является наименее устойчивой.
Известно, что кислородные соединения хлора, в особенности его оксиды, неустойчивы и легко разлагаются.
Большое применение имеют кислородные соединения хлора, благодаря окисляющим и отбеливающим способностям.
Из солей кислородсодержащих кислот широко известны бертолетова соль (хлорат калия) KClO3 и хлорная («белильная») известь.
3. ОВР. S + NaOH
3 S + 6 NaOH = 2 Na2S + Na2SO3 + 3 H20
Рекреация диспропорционирования, то есть один и тот же элемент одновременно и и окисляется, и восстанавливается.
S + 2e- = S-- | *2
S + 6 OH- - 4e- = SO3-- +3 H2O | *1
S + NaOH → Na2SO3 + Na2S.
--------------------------------------------------------------------------------------------------------------------------
атомные орбитали. Законы расположения электронов в атоме.
