Компьютеризированная лабораторная работа № 11
Определение значений водородного показателя (рН) водных растворов
Цель работы:определить значения pH ряда водных растворов методом потенциометрии. Для этого необходимо:
- измерить ЭДС гальванического элемента с раствором, pH которого известна, составленного из стеклянного и хлорсеребряного электродов;
- измерить ЭДС гальванического элемента с различными растворами, pH которых неизвестна;
- рассчитать значения pH исследованных растворов.
Теоретическая часть
В настоящее время кислотность среды принято выражать с помощью водородного показателя (pH). Водородный показатель это отрицательный десятичный логарифм активности иона водорода в растворе.
pH = -lgсH+
Так как ионное произведение воды KW = сH+ сOH- = 10-14 при 298 К, то при значениях pH меньше 7 ионов водорода будет больше, чем гидроксид-ионов и говорят, что среда кислая. Если же значение pH больше 7, то соответственно, говорят, что среда щелочная.
Измерение водородного показателя методом потенциометрии осуществляется при помощи электродов, потенциал которых зависит от концентрации иона водорода в растворе. Наиболее распространенными для этой цели в лабораторной практике является стеклянный электрод.
Стеклянный электрод – ион-селективный электрод селективный по отношению к ионам водорода находящимся в растворе. Потенциал стеклянного электрода зависит от концентрации ионов водорода следующим образом:
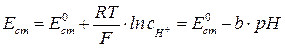 , b = R×T×ln10/F. (1)
, b = R×T×ln10/F. (1)
Для определения рН некоторого раствора составляют цепь, состоящую из стеклянного электрода, погруженного в исследуемый раствор, и электрода сравнения, потенциал которого сохраняется постоянным в ходе эксперимента. В современной практике в качестве электрода сравнения обычно используется насыщенный хлорсеребряный электрод (ХСЭ). Тогда мы можем записать ЭДС всей цепи
E = Eст – EХСЭ = E0ст –b× pH - EХСЭ. (2)
Следовательно, потенциал такого элемента будет линеен относительно значения рН. Зная потенциал элемента, содержащего раствор с известным значением рН, можно рассчитать значение всех постоянных величин, входящих в уравнение. В нашем случае – это стандартный потенциал стеклянного электрода и потенциал ХСЭ. Обозначим их разницу как Е' и выразим через потенциал элемента и значение рН раствора
Е' = E0ст – EХСЭ = E –b× pH. (3)
Экспериментально определив Е'мы сможем определить рН другого раствора, с неизвестным значением рН, по формуле
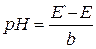 . (4)
. (4)
Для экспериментального определения Е'используют буферные растворы с приписанными значениями рН. Составы буферных растворов и приписанное им значение рН можно найти в справочной литературе. Промышленностью выпускаются стандарт-титры для приготовления буферных растворов.
Применяемые для рН-метрии стеклянные электроды, имеют линейную характеристику в довольно широких диапазонах температур и значений рН. Например, электрод ЭСЛ-43-07 имеет линейную характеристику в диапазоне значений рН от 0 до 12 (при 298 К).
В настоящее время измерение значений рН с помощью стеклянного электрода получило наибольшее распространение в лабораторной практике. Однако наряду с достоинствами он имеет и ряд недостатков. Главный его недостаток это хрупкость (поэтому обращайтесь со стеклянным электродом предельно осторожно). Другим его недостатком является достаточно долгое установление равновесного значения потенциала (около пяти минут). Сопротивление стеклянного электрода достаточно велико (от десятков до сотен МОм), поэтому при работе с ним необходимо использовать потенциометры с высоким входным сопротивлением.
Экспериментальная часть
Приборы и реактивы
1. Учебно-лабораторный комплекс « Химия» в следующей комплектации:
- центральный контроллер;
- модуль «Электрохимия» в комплекте с двумя стаканчиками (50 см3), датчиком температуры, стеклянным, хлорсеребряным электродами и шнурами для подсоединения электродов;
2. Буферный раствор с известным значением pH и растворы, pH которых требуется определить, дистиллированная вода.
