Влияние концентрации на скорость реакции
Скорость химической реакции определяется вероятностью столкновений молекул, т.е. зависит от концентрации реагирующих веществ. Русский ученый Н.Н. Бекетов (1865 г.) и норвежские ученые К. Гульдберг и П. Вааге (1867 г.) вывели закон действия масс. Закон действия масс является основным законом химической кинетики.
Закон действия масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов, при постоянной температуре.
Например, для реакции 2Н2(г) + О2(г) ⇄ 2Н2О(п) скорость прямой химической реакции (v пр) зависит от концентрации водорода ( 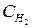 ) и кислорода (
) и кислорода ( 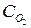 ) и выражается соотношением
) и выражается соотношением
v пр. = 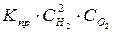 ;
;
Скорость обратной реакции (v обр.) в соответствии с законом действия масс можно выразить следующим образом:
v обр. = 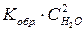 ,
,
где Кпр. и Кобр. – коэффициенты пропорциональности, они же являются константами скорости реакции.
Константа скорости реакции не зависит от концентрации, а зависит от природы реагирующих веществ и температуры.
Для гомогенных систем все концентрации взаимодействующих веществ входят в математическое выражение закона действующих масс, как это видно из приведенного примера.
Для гетерогенных систем, например, взаимодействие металла с кислородом 2Zn(т) + О2(г) = 2ZnО(т) в уравнение закона действия масс вводится только концентрация кислорода
v пр= 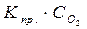 .
.
Концентрация металла при данной температуре остается практически постоянной и поэтому может быть введена в величину константы скорости реакции. Если реакция между твердым телом и жидкостью осуществляется в основном в жидкой фазе, тогда в выражение закона действия масс вводится только концентрация вещества, находившегося с начала процесса в жидкой фазе. Концентрация растворяющегося вещества остается при данной температуре постоянной и может быть введена в константу. Например, для реакции
Zn(т) + 2 НСl(ж) = ZnСl2(ж) + Н2(г) прямая реакция v пр = Кпр. · С2НСl, обратная v обр= Кобр. · 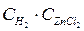 .
.
Химическое равновесие
Итак, химические реакции могут проходить как в прямом, так и в обратном направлении. Такие реакции называются обратимыми.В том случае, когда состав системы с течением времени не изменяется, состояние такой химической системы называют химическим равновесием. В этом состоянии противоположно направленные реакции имеют одинаковые скорости. Следовательно, химическое равновесие является динамическим (подвижным).
Следовательно, при равенстве скоростей прямой и обратной реакции (v пр = v обр) наступает химическое равновесие. Например, для реакции
Н2 +Сl2 ⇆ 2Н Сl v пр = Кпр. · 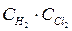 v обр. = Кобр. ×
v обр. = Кобр. × 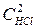
В состоянии равновесия v пр = v обр. При равенстве левых частей уравнения приравниваются и правые части Кпр × 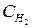 ×
× 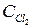 = Кобр = Кобр ×
= Кобр = Кобр × 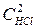
Количественно химическое равновесие характеризуется константой равновесия (Кр.) Выражение для константы химического равновесия является выражениями закона действия масс одновременно для прямой и обратной реакции. Константа равновесия есть отношение констант скоростей реакции при данной температуре.
Для реакции 2Н2 + О2 = 2Н2О при равновесии 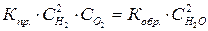 . Если разделить каждую часть равенства на произведение
. Если разделить каждую часть равенства на произведение 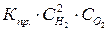 , то получим
, то получим
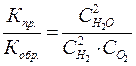 .
.
Это отношение носит название константы равновесия и обозначается Кр, Константу равновесия можно определить как отношение констант скоростей прямой и обратной реакций 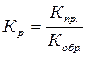 или какотношение произведения концентрации продуктов реакции в степени их стехиометрических коэффициентов на произведение концентрации исходных веществ в степени их стехиометрических коэффициентов
или какотношение произведения концентрации продуктов реакции в степени их стехиометрических коэффициентов на произведение концентрации исходных веществ в степени их стехиометрических коэффициентов 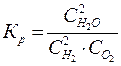 .
.
Константа равновесия зависит от природы веществ и температуры, но не зависит от концентрации.
Однако состояние химического равновесия, в котором находится любая система, сохраняется до тех пор, пока не изменяются внешние условия. В этом случае прямая и обратная реакции меняются не одинаково, и система уже не будет находиться в состоянии равновесия, происходит смещение химического равновесия. Закономерности, которые отмечаются при смещении химического равновесия, качественно описываются принципом Ле Шателье (1884 г.).
Принцип Ле Шателье:при всяком внешнем воздействии на систему, находящуюся в состоянии химического равновесия, в ней протекают процессы, приводящие к уменьшению этого воздействия.
Поэтому при увеличении концентрации одного из веществ, составляющих систему, происходит стремление к усиленному расходу именно этого вещества и равновесие уменьшается в сторону снижения концентрации. Например, при повышении концентрации кислорода или водорода равновесие реакции 2Н2(г) + О2(г) ⇆ 2Н2О(п) сместится в сторону образования воды.
При изменении давления происходит изменение объема в процессе химической реакции. Следовательно, при увеличении давления равновесие смещается в направлении реакции, идущей с уменьшением числа молекул, и, наоборот, понижение давления вызывает смещения равновесия в сторону реакции с увеличением числа молекул. Например, в реакции 2Н2 + О2 ⇄ 2Н2О увеличение давления ведет к смещению равновесия в сторону образования воды.
При повышении температуры ускоряются прямая и обратная реакции, но в большей мере ускоряются эндотермические, поэтому равновесие смещается в направлении эндотермического процесса. Например, реакция 2Н2 + О2 = 2Н2О в прямом направлении протекает с выделением тепла (DН < О, Q > О), а в обратном направлении – с поглощением тепла (DН > О, Q <О). При увеличении температуры равновесие может сместиться в сторону образования водорода и кислорода при разложении воды, т.е. в сторону эндотермической реакции.
Реактивы и оборудование
В работе используют:
§ 0,2 М; 0,3 М; 0,5 М; 1,0 М растворы тиосульфата натрия (Nа2S2О3);
§ раствор, содержащий 1мас.ч. серной кислоты (Н2SО4) : 200 мас.ч. Н2О;
§ 0,005М; 1,0 М растворы хлорида железа (FеСl3);
§ 0,005М; 1,0 М растворы роданида аммония (NН4 СNS);
§ Хлорид аммония или натрия (кристаллический);
§ Фотоэлектроколориметр типа КФК-3.
Экспериментальная часть
