Правила работы в химических лабораториях.
РОССИЙСКАЯ ФЕДЕРАЦИЯ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Институт физики и химии
Кафедра неорганической и физической химии
А. В. Кертман, Т. М. Бурханова
ОБЩАЯ ХИМИЯ
Учебно-методический комплекс:
Методические указания для студентов 1 курса
направления 020400.62 «БИОЛОГИЯ»
Тюмень
Издательство
Тюменского государственного университета
УДК 542
ББК
А. В. Кертман, Т. М. Бурханова. Общая химия: Учебно-методический комплекс. Методические указания для студентов 1 курса направления 020400.62 «БИОЛОГИЯ». Тюмень: Издательство Тюменского государственного университета, 2013, 38 стр.
Учебно-методический комплекс написан в соответствии с рабочей программой курса «Общая химия» читаемого студентам 1 курса Института биологии направления 020400.62 «Биология». Данный выпуск содержит описание лабораторных работ по кислотно-основным и окислительно-восстановительным свойствам соединений, изучению скоростей химических реакций, химических равновесий в растворах. Приведены краткие теоретические сведения по некоторым разделам курса, даны контрольные вопросы.
Рабочая программа дисциплины опубликована на сайте ТюмГУ: Общая химия [электронный ресурс] / Режим доступа: http://www.umk3.utmn.ru., свободный.
Рекомендовано к изданию кафедрой неорганической и физической химии. Утверждено проректором по учебной работе Тюменского государственного университета.
ОТВЕТСТВЕННЫЙ ЗА ВЫПУСК: О.В. Андреев, зав. кафедрой неорганической и физической химии, д-р хим. наук, профессор
Рецензенты:
© ФГБОУ ВПО Тюменский государственный университет, 2013
© А. В. Кертман, Т. М. Бурханова, 2013
Правила безопасной работы с электрооборудованием
И электроприборами
Электрический ток может вызвать пожар, взрыв, причиной которого могут быть искры, нагретые токопроводящие части, короткое замыкание. При работе с электрооборудованием возможны случаи поражения людей электрическим током, причиной чего могут быть:
· работа при неисправном оборудовании;
· прикосновение руками или металлическими предметами к оголенным токонесущим проводам;
· нарушение правил пользования электроприборами.
Поэтому работы в лаборатории должны проводиться только при исправном оборудовании.
Запрещается переносить включенные приборы и ремонтировать оборудование, находящееся под током.
Запрещается работать вблизи открытых токопроводящих частей оборудования, загромождать проходы к электрическим устройствам, вешать на штепсельные розетки, выключатели, электропровода различные предметы, укреплять провода веревкой или проволокой. В случае отключения электроэнергии все электроприборы должны быть немедленно выключены. В случае загорания проводов или электроприборов немедленно обесточить их и гасить углекислым огнетушителем, асбестовым одеялом или сухим песком.
ЛАБОРАТОРНАЯ РАБОТА № 1
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
Опыт 1: Получение и свойства оксидов.
а) В пробирку поместить немного оксида кальция и прилить 1-2 мл дистиллированной воды. Испытать реакцию раствора полоской универсальной индикаторной бумаги и фенолфталеином. Написать уравнения реакции.
б) В пробирку налить 1 мл раствора сульфата меди (II) и прилить раствор гидроксида натрия до выпадения осадка. Пробирку с осадком нагреть до кипения. Что происходит, почему? Полученный осадок проверить на растворимость в воде, кислоте и щелочи. Написать уравнения протекаемых реакций.
в) На керамическую плитку поместить немного красного фосфора и накрыть его воронкой с надетой на нее сухой пробиркой. Под край воронки положить стеклянную палочку так, чтобы образовалась щель для доступа воздуха. Нагретой стеклянной палочкой поджечь фосфор (ТЯГА!). По окончании реакции воронку перевернуть вместе с пробиркой и прилить 1-2 мл воды. Испытать реакцию полученного раствора полосками универсальной индикаторной и синей лакмусовой бумаги. Написать уравнения реакций.
г) Алюминиевую проволоку очистить наждачной бумагой. На очищенную поверхность нанести каплю раствора ртути (I). Когда поверхность металла под раствором станет серой, каплю стряхнуть, мокрое место растереть фильтровальной бумагой и оставить металл на воздухе. Что наблюдается? Образующиеся хлопья оксида собрать и исследовать на растворимость в воде, кислоте и щелочи. Написать уравнения реакций.
Опыт 2: Получение и свойства гидроксидов.
а) Получить раствор гидроксида натрия. Испытать реакцию раствора полоской индикаторной бумаги и фенолфталеином. Написать уравнение реакции.
б) Получить гидроксид никеля и исследовать его отношение к кислоте и щелочи. Написать уравнения реакций в молекулярных и сокращенно-ионных формах.
в) Получить гидроксид хрома (III) и исследовать его отношение к кислоте и щелочи. Написать уравнения реакций в молекулярных и сокращенно-ионных формах.
Опыт 3: Получение и свойства солей.
а) Испытать действие щелочи, концентрированной и разбавленной серной кислоты на цинк и медь. Записать результаты наблюдений и уравнения реакций.
б) Проделать качественные реакции, доказывающие, что данный Вам раствор является раствором хлорида бария. Написать уравнения реакций в молекулярных и сокращенно-ионных формах.
в) В растворы сульфатов меди и цинка опустить по кусочку стальной проволоки. Что происходит? Написать уравнения реакций.
г) В одну пробирку налить небольшое количество раствора хромата, в другую - бихромата. Какова окраска растворов, обусловленная ионами CrO42- и Cr2O72-? Прибавить в первую пробирку несколько капель раствора серной кислоты, в другую - столько же раствора щелочи. Как изменилась окраска растворов? Написать уравнения реакций в молекулярных и ионных формах с учетом обратимости процесса перехода хромат-иона в бихромат-ион.
ВОПРОСЫ САМОКОНТРОЛЯ ПО ТЕМЕ
"КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ"
1. Какие из оксидов - CO2, CaO, P2O5, NO2, SO2 способны к солеобразованию: а) с кислотами, б) со щелочами? Ответ проиллюстрировать уравнениями реакций. Назвать оксиды.
2. Закончить уравнения реакций:
NaOH + Cl2O7 ® Zn + H2SO4 (конц.) ®
Zn + H2SO4 (разб.) ® Al + H2SO4 (разб.) ®
Cr(OH)3 + H3AsO4 ® Cr(OH)3 + NaOH ®
ZnOHCl + H2SO4 ® BiOCl + H2SO4 ®
PBr3 + H2O ® Cl2 + H2O ®
3. Осуществить превращения:
Na2CO3 ® NaHCO3 Zn ® ZnSO4
NaHCO3 ® Na2CO3 ZnSO4 ® Zn
4. Предложить не менее пяти различных способов получения ZnSO4.
5. Получить нитрат аммония из воды и воздуха.
6. В каком направлении и почему будет смещаться равновесие:
2H+ + 2CrO42- Û Cr2O72- + H2O
при добавлении щелочи и кислоты.
ЛАБОРАТОРНАЯ РАБОТА № 2
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
Опыт 1: Влияние концентрации реагирующих веществ на скорость гомогенной химической реакции.
В четыре стакана емкостью 100 мл налить по 20 мл раствора сульфита натрия, подкисленного серной кислотой и содержащего небольшое количество крахмала (1 г соли, 0,95 мл концентрированной серной кислоты, 0,1 г крахмала в 1 л раствора). В четыре других стаканчика налить 20, 10, 5 и 2,5 мл раствора иодата калия KJO3 (3,9 г соли в 1 л раствора). В последние три из четырех стаканчиков добавить соответственно 10, 15 и 17,5 мл дистиллированной воды. Сливая попарно растворы сульфита натрия и иодата калия, отмечать по секундомеру время появления окраски. Результаты записать в таблицу:
Построить график зависимости относительной скорости реакции 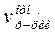 от относительной концентрации иодата калия С(KJO3)отн.. Написать уравнение реакции в молекулярной и сокращенно-ионной формах. Отвечает ли это уравнение механизму протекания реакции? Ответ обосновать.
от относительной концентрации иодата калия С(KJO3)отн.. Написать уравнение реакции в молекулярной и сокращенно-ионной формах. Отвечает ли это уравнение механизму протекания реакции? Ответ обосновать.
| Номер опыта | V(KJO3), мл | V(Na2SO3), мл | С(KJO3)отн. | Время t, с. | uр-цииотн., 1/c |
| 2.5 | |||||
Опыт 2: Влияние величины поверхности на скорость гетерогенной химической реакции.
В две пробирки поместить равные по массе (не более 0,3 г) образцы мела: в одну пробирку порошок, в другую - кусочек. В обе пробирки одновременно влить по 1-2 мл 2н. НСl. Сравнить скорость растворения мела в обеих пробирках. Написать уравнение реакции.
Опыт 3: Автокатализ.
Автокаталитическими называют реакции, катализатором в которых служит один из продуктов реакции. Примером является окисление щавелевой кислоты перманганатом в кислой среде:
2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ +10CO2 +8H2O
Катализатором этой реакции служат ионы Мn2+. В две пробирки налить по 1-2 мл разбавленного раствора перманганата калия, подкислить раствором серной кислоты и прилить равные объемы 1М раствора щавелевой кислоты. В одну из пробирок бросить кристаллик соли марганца (II). Сравнить скорость окисления щавелевой кислоты в обеих пробирках.
Опыт 4: Смещение химического равновесия при изменении концентрации реагирующих веществ.
К 20 мл дистиллированной воды в химическом стаканчике добавить по 1-2 капли растворов хлорида железа (III) и роданида аммония. Что происходит? Написать уравнение реакции. Полученный раствор разлить в 4 пробирки (по 1-2 мл). В первую добавить несколько капель концентрированного раствора хлорида железа (III), во вторую - концентрированного раствора роданида аммония, в третью - концентрированного раствора хлорида аммония, четвертую оставить для сравнения. Как изменяется интенсивность окраски раствора в первых трех пробирках? Дать объяснение, пользуясь выражением константы равновесия и принципом Ле-Шателье.
Опыт 5: Влияние температуры на химическое равновесие.
При взаимодействии иода с крахмалом образуется вещество сложного состава - иодокрахмал. Реакция экзотермическая и равновесие ее условно представить схемой:
иод + крахмал Û иодокрахмал + Q; DНор-ции < 0
В две пробирки налить по 5 мл свежеприготовленного раствора крахмала и добавить 1-4 капли раствора иода, содержащего небольшое количество иодида калия. Что наблюдаете? Одну из пробирок нагреть и сравнить с контрольной пробиркой. Охладить нагретую пробирку водой из под крана. Сравнить с контрольной пробиркой. Результаты опыта записать в таблицу:
| Номер опыта | Изменение температуры | Изменение интенсивности окраски | Скорость какой реакции увеличилась | Направление смещения равновесия |
Опыт 6: Ингибирование коррозии.
В два стаканчика поместить стальную проволоку (скрепка, гвоздь) и прилить по несколько мл соляной кислоты. В один из стаканов добавить 1-2 мл 40%-ного раствора формалина. Сравнить скорость коррозии стали в обоих стаканчиках.
ВОПРОСЫ САМОКОНТРОЛЯ ПО ТЕМЕ
"ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ"
1. Какая реакция называется самопроизвольной? Должна ли самопроизвольная реакция обязательно быть быстропротекающей?
2. Какие реакции называются практически необратимыми (односторонними)? Приведите примеры обратимых реакций.
3. Дать определение и математическое выражение скорости химической реакции.
4. Что называется константой скорости химической реакции и от каких факторов она зависит?
5. Сформулировать закон действующих масс и привести примеры.
6. Каков физический смысл константы химического равновесия и от каких факторов она зависит?
7. Написать уравнение закона действующих масс для следующих обратимых процессов:
а) Cl2 + H2O Û Cl- + H+ + HClO;
б) mA + nB Û pC
8. Каким образом константа равновесия связана с константами скорости прямой и обратной реакции?
9. Вычислить константу химического равновесия реакции NaCl + H2SO4 Û NaHSO4 + HCl, если равновесные концентрации [NaCl] и [H2SO4] составляют по 1 моль/л, а [NaHSO4] и [HCl] - по 0,4 моль/л.
10. Сформулировать принцип Ле-Шателье.
11. Как сместить равновесие вправо:
а) 3H2 + N2 Û 2NH3; DHo < 0
б) H2 + I2 Û 2HI; DHo < 0
в) 3O2 Û 2O3; DHo > 0
г) CN- + H2O Û HCN + OH-
д) Zn2+ + H2S Û ZnS + 2H+
ЛАБОРАТОРНАЯ РАБОТА № 3
ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ.
Водородный показатель рН. Вода, являясь слабым электролитом, в очень малой степени диссоциирует на ионы:
H2O Û H+ + OH-
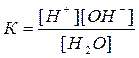
Применив к данному обратимому процессу закон действующих масс:
Приняв концентрацию воды [H2O] величиной постоянной, равной 1000/18=55,56 моль/л, уравнение можно записать так:
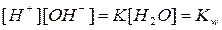
Kw - постоянная величина - называется ионным произведением воды и при 22oС равна 10-14. Для чистой воды концентрация ионов водорода равна концентрации гидроксид-ионов. Следовательно, при 22oС
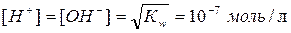
Десятичный логарифм концентрации водородных ионов, взятый с обратным знаком, называется водородным показателем и обозначается рН, т.е. рН = -lg[H+]. Понятие рН удобно применять для характеристики реакции растворов: нейтральная - рН = 7; кислая - рН < 7, щелочная - рН > 7
Гидролиз солей. Гидролизом соли называется взаимодействие ионов соли с водой, приводящее к образованию слабого электролита и (чаще всего, но не всегда) к избыточному содержанию в растворе ионов Н+ или ионов ОН-.
Различают 4 случая гидролиза:
1. Гидролиз по катиону характеризует соли, образованные сильной кислотой и слабым основанием. В этом случае катион соли связывает ионы ОН воды, что смещает равновесие системы Н2О Û Н+ + ОН- вправо. [H+] > [OH-] - среда кислая, рН < 7.
2. Гидролиз по аниону характеризует соли, образованные слабой кислотой и сильным основанием. В этом случае анион соли связывает ионы Н+ воды и в растворе накапливаются ионы ОН-. [OH-] > [H+] - среда щелочная, рН > 7.
3. Гидролиз по катиону и аниону - свойственен солям, образованным слабой кислотой и слабым основанием. Реакция растворов таких солей определяется соотношением величин констант диссоциации продуктов гидролиза.
4. Соли, образованные сильными кислотами и основаниями не содержат в своем составе ионов, способных к взаимодействию с водой, поэтому гидролизу не подвергаются.
Количественной оценкой гидролиза являются степень и константа гидролиза. Степенью гидролиза h называется отношение числа молекул, подвергшихся гидролизу, к общему числу растворенных молекул: h=cг/с. Степень гидролиза тем больше, чем больше Кw, т.е. чем больше температура (так как Кw возрастает с температурой); чем меньше Кдисс., т.е. чем слабее кислота (основание), которая образуется в результате гидролиза соли; чем меньше концентрация, т.е. чем больше разбавлен раствор.
Константой гидролиза Кг. называется отношение произведения концентраций продуктов гидролиза к концентрации негидролизованной соли. Для реакции CN- + HOH Û HCN + OH- константа гидролиза запишется в виде:
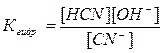
Величина Кгидр., в отличие от степени гидролиза, не зависит от концентрации раствора, поэтому является более удобной характеристикой процесса. Обе величины связаны между собой отношением:
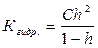
 При малых значениях h:
При малых значениях h:
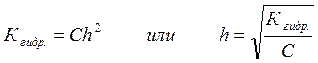

Гетерогенные равновесия. Произведение растворимости. Абсолютно нерастворимых веществ нет. Поэтому ничтожная часть даже самого нерастворимого вещества, например AgCl, все же переходит в раствор. Со временем между твердой фазой (осадком) и ионами в растворе устанавливается подвижное равновесие:
AgCl (осадок) Û Ag+ + Cl- (раствор)
Таким образом, в гетерогенной системе, состоящей из осадка и насыщенного относительно него раствора, непрерывно протекают два процесса с одинаковой скоростью: переход ионов в раствор и их осаждение на поверхности кристаллов. Произведение растворимости - постоянная величина при данной температуре - представляет собой произведение концентраций ионов в насыщенном растворе малорастворимого электролита. Обычно его обозначают символом ПР с индексом, указывающим, к какому электролиту он относится, например [Ag+][Cl-] = ПРAgCl. Надо иметь ввиду, что ПР постоянно только для насыщенных растворов малорастворимых веществ (например AgI, BaSO4, но не NaCl). ПР характеризует растворимость вещества: чем больше ПР, тем больше растворимость.
При [Ag+][Cl-] < ПРAgCl - раствор ненасыщенный,
[Ag+][Cl-] = ПРAgCl - раствор насыщенный,
[Ag+][Cl-] > ПРAgCl - раствор пересыщенный.
Добавляя к ненасыщенному раствору электролита электролит с одноименным ионом, можно превратить его в насыщенный и пересыщенный. Из понятия ПР вытекает условие образования осадков: малорастворимый электролит всегда выпадает в осадок, когда произведение концентраций ионов сделается больше величины ПР электролита, т.е. в случае AgCl, когда [Ag+][Cl-] >> ПРAgCl. Это будет достигнуто прибавлением избытка электролита, содержащего Ag+ - или Cl- -ионы. Растворение осадка происходит тогда, когда произведение концентраций ионов сделается меньше величины ПР электролита, т.е. в случае AgCl, когда [Ag+][Cl-] << ПРAgCl.Этого можно достигнуть, связывая один из ионов, посылаемых осадком в раствор. Это осуществляется образованием: 1) малодиссоциированного соединения; 2) комплексного иона; 3) менее растворимого соединения; 4) изменением заряда иона в окислительно-восстановительной реакции.
Буферные растворы. Буферные растворы - это такие растворы, рН которых почти не зависит от разбавления, концентрирования и мало изменяется при прибавлении к ним небольших количеств кислот или щелочей, не превышающих некоторого предела. Обычно буферными являются растворы, содержащие слабую кислоту и ее соль, образованную сильным основанием, или слабое основание и его соль, образованную сильной кислотой. Буферной емкостью называется число эквивалентов N кислоты или основания, необходимое для смещения рН одного литра буферного раствора на одну единицу. Она вычисляется по формуле:
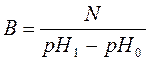
где рН0 - исходное значение, а рН1 - после добавления кислоты или щелочи. Буферная емкость раствора тем выше, чем больше концентрация компонентов и чем меньше эти концентрации отличаются друг от друга. Каждый буферный раствор имеет определенное значение рН, которое можно рассчитать, пользуясь соответствующими формулами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
Опыт 1: Влияние одноименного иона на степень диссоциации слабых электролитов.
а) В пробирку налить 1-2 мл 2н. уксусной кислоты и полоской универсальной индикаторной бумаги определить рН раствора. Добавить в раствор небольшое количество кристаллического ацетата натрия, перемешать и снова определить рН. Объяснить наблюдаемые явления.
б) В пробирку налить 1-2 мл раствора аммиака и измерить значение рН полоской индикаторной бумаги. Внести в пробирку небольшое количество кристаллического хлорида аммония и хорошо взболтать и снова определить значение рН. Объяснить наблюдаемые явления.
Опыт 2: Буферные растворы.
а) Смешением равных объемов 0,2 М растворов уксусной кислоты и ацетата натрия приготовить несколько мл ацетатного буферного раствора и полоской универсальной индикаторной бумаги измерить его рН.
б) В две пробирки налить по 1-2 мл приготовленного ацетатного буферного раствора. В одну из них добавить каплю 1н. соляной кислоты, в другую - 1н. раствора едкого натра. Определить рН полученных растворов универсальной индикаторной бумажкой и сравнить с исходным значением рН ацетатного буферного раствора (см. опыт 2а). Проделать аналогичный опыт, заменив буферный раствор дистиллированной водой. Объяснить наблюдаемые явления. В чем состоит действие буферных растворов?
в) В стаканчик налить несколько капель приготовленного ацетатного буферного раствора и добавить стократное количество дистиллированной воды. Измерить рН полученного раствора универсальной индикаторной бумажкой. Изменилось ли значение рН по сравнению с исходным (см. опыт 2а).
Опыт 3: Гидролиз солей.
а) Определение характера гидролиза. В пробирки налить по 1-2 мл растворов иодата калия, хлорида аммония, ацетата натрия, хлорида натрия, хлорида магния, хлорида алюминия, сульфата калия и универсальной индикаторной бумажкой определить значения рН. Все ли соли подвергаются гидролизу? Отчего зависит степень гидролиза?
б) Влияние температуры на гидролиз. В пробирку налить 1-2 мл 1н. раствора ацетата натрия и полоской универсальной индикаторной бумаги определить значение рН. Раствор прокипятить и снова измерить рН. Объяснить наблюдаемые явления.
в) Влияние разбавления на гидролиз. В пробирку налить несколько капель концентрированного раствора хлорида сурьмы (III) и добавить по каплям дистиллированную воду до выпадения осадка оксохлорида сурьмы. Написать уравнение гидролиза SbCl3. Затем прибавить несколько капель концентрированной соляной кислоты до растворения осадка. Объяснить наблюдаемые явления.
г) Необратимый гидролиз. В пробирку налить 1-2 мл раствора соли алюминия и прилить равный объем раствора карбоната натрия. Что происходит? Объяснить наблюдаемое явление. Написать уравнение реакции в молекулярной и сокращенно-ионной формах.
Опыт 4: Гетерогенные равновесия.
а) Условия растворения осадков. В пробирку налить 1-2 мл раствора оксалата натрия и прилить равный объем раствора хлорида кальция. Что наблюдается? Написать уравнение реакции в молекулярной и сокращенно-ионной формах. Полученный осадок испытать на растворимость в соляной и уксусной кислотах. Объяснить наблюдаемые явления, пользуясь значениями констант диссоциации соответствующих кислот и произведения растворимости оксалата кальция.
б) Получение одних малорастворимых веществ из других. В пробирке смешать 1-2 мл раствора нитрата свинца с таким же количеством раствора сульфата натрия. Написать уравнение реакции. Осадок отцентрифугировать, добавить к нему 1-2 мл раствора сульфида аммония и хорошо перемешать. Какое вещество образовалось? Пользуясь правилом произведения растворимости, объяснить переход одного осадка в другой.
ВОПРОСЫ САМОКОНТРОЛЯ ПО ТЕМЕ
"ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ".
1. Чем объясняется различная электропроводность водного и спиртового раствора одной и той же соли при равенстве концентраций?
2. Что называется степенью диссоциации? От каких факторов она зависит? Написать математическое выражение закона разбавления Оствальда.
3. От каких факторов зависит степень электролитической диссоциации? Как ее увеличить? Как уменьшить?
4. Почему для характеристики диссоциации сильных электролитов применяют термин "кажущаяся степень диссоциации"?
5. Какой физический смысл имеет изотонический коэффициент Вант-Гоффа? Как связан изотонический коэффициент со степенью диссоциации?
6. Что называется ионным произведением воды и отчего оно зависит?
7. Что такое рН?
8. Как влияют температура и разбавление на гидролиз солей?
9. Почему не все соли гидролизуются? Какие соли не подвергаются гидролизу?
10. Вычислить водородный и гидроксильный показатели (рН и рОН) децинормального раствора азотной кислоты.
11. Вычислить рН 3,12 %-ного раствора соляной кислоты, плотность которого равна 1,015.
12. Вычислить концентрацию ионов водорода и гидроксид-ионов, если рН раствора равен 0,3.
13. Объяснить, почему растворы солей могут иметь: а) кислую; б) щелочную; в) нейтральную реакцию. Привести примеры.
14. Написать молекулярные и сокращенно-ионное уравнения гидролиза солей: а) (NH4)2CO3; б) Na3PO4.
15. Написать уравнения следующих реакций (с учетом возможности необратимого гидролиза образуемых солей):
a) Fe2(SO4)3 + K2CO3 =
б) Al2(SO4)3 + (NH4)2S =
16. Какая из двух солей сильнее гидролизуется: Na2S или Al2S3? Почему?
17. Почему растворы солей NaF и NaClO имеют щелочную реакцию? Написать уравнения гидролиза этих солей.
18. Вычислить значение рН 0,1М раствора СН3СООNа.
19. Что называется буферным раствором? Какими свойствами он обладает?
20. Объяснить, почему рН буферного раствора при добавлении небольших количеств кислоты или щелочи практически не меняется?
21. Как влияет разбавление на буферную емкость раствора?
22. Вычислить рН смеси растворов: а) 0,1н. NH4OH и 1н. NH4Cl; б) 0,1н. NH4OH и 2н. NH4Cl.
23. Что называется произведением растворимости?
24. Что нужно сделать для достижения более полного осаждения Zn2+ в виде ZnS?
25. Что нужно сделать, чтобы растворить осадок Fe(OH)3?
26. Произведение растворимости CaCO3 при некоторой температуре равно 2,25×10-8. Вычислить: а) концентрацию ионов кальция в насыщенном растворе этой соли; б) растворимость карбоната кальция.
27. Растворимость сульфата бария в воде равна 1 : 428000. Вычислить произведение растворимости сульфата бария.
28. Вычислить произведение растворимости Ag2CrO4, если растворимость этой соли равна 0,025 г/л.
29. Вычислить, какие минимальные концентрации растворов CuSO4 и (NH4)2S следует взять, чтобы при смешении их равных объемов выпал осадок СuS.
30. При каком рН начнет осаждаться гидроксид магния из 2н. раствора хлорида? Произведение гидроксида магния равно 5×10-12.
31. Выпадет ли осадок сульфида железа (II) из 0,01н. раствора сульфата железа (II), содержащего 0,1 моль/л соляной кислоты, при пропускании в него сероводорода до насыщения? Концентрация насыщенного раствора сероводорода составляет 0,1 моль/л. Произведение растворимости сульфида железа (II) равно 3×10-9.
32. Сколько процентов цинка будет осаждено в виде сульфида из 0,1М раствора хлорида цинка сероводородом в присутствии формиатной буферной смеси, поддерживающей рН равным двум? Произведение растворимости сульфида цинка равно 1,2×10-23. Концентрация насыщенного раствора сероводорода составляет 0,1 моль/л.
33. Определить, будет ли выпадать осадок хлорида серебра при смешении 10 мл 1×10-6 н. раствора нитрата серебра с 10 мл 1×10-5 н. раствора хлорида натрия.
34. Смешивают 20 мл 0,01н. раствора KCl с 5 мл 0,001н. раствора AgNO3. Определить, выпадает ли в этих условиях осадок AgCl?
ЛАБОРАТОРНАЯ РАБОТА № 4
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
Опыт 1: Окислительно-восстановительные свойства простых веществ.
а) В пробирку поместить кусочек медной проволоки и прилить 1-2 мл концентрированной азотной кислоты. Пробирку подогреть на спиртовке (тяга!). Что происходит? Написать уравнение реакции, пользуясь электронно-ионным методом.
б) В пробирку налить 1-2 мл бромной воды и добавить немного цинковой пыли. Содержимое пробирки взболтать и дать отстояться. Что наблюдается? Написать уравнение реакции.
Опыт 2: Влияние среды на протекание окислительно-восстановительных реакций.
В три пробирки налить по 1-2 мл 0,05 М раствора перманганата калия. В первую добавить несколько капель концентрированной серной кислоты, во вторую - дистиллированной воды, в третью - концентрированного раствора едкого натра. Во все три пробирки прилить двукратный объем 1 М раствора сульфита натрия. Что происходит? Написать уравнения реакций, пользуясь электронно-ионным методом. Вычислить эквиваленты окислителя и восстановителя в этих реакциях. В третью пробирку добавить дистиллированной воды до исчезновения изумрудно-зеленой окраски. Что наблюдается? Написать уравнение реакции, пользуясь электронно-ионным методом. К какому типу ОВР относится эта реакция?
Опыт 3: Окислительно-восстановительная двойственность.
В две пробирки налить по 1-2 мл подкисленного раствора нитрита натрия. В одну из них добавить несколько капель раствора перманганата калия, в другую - йодида калия и крахмала. Что происходит? Написать уравнения реакций, пользуясь электронно-ионным методом. В чем состоит условие проявления веществом окислительно-восстановительной двойственности? Вычислить эквиваленты окислителей и восстановителей в проведенных реакциях.
Опыт 4: Окислительные и восстановительные свойства перекиси водорода.
а) В пробирку налить 1-2 мл раствора пероксида водорода и добавить немного оксида марганца (IV). Что происходит? Написать уравнение реакции, пользуясь электронно-ионным методом. К какому типу ОВР относится эта реакция?
б) К 1-2 мл раствора иодида калия добавить такое же количество 2н. раствора серной кислоты и затем по каплям прибавлять раствор пероксида водорода до появления желтой окраски. Что является продуктом реакции и как это определить? Написать уравнение реакции, пользуясь электронно-ионным методом.
в) К 1-2 мл раствора перманганата калия добавить такое же количество 2н. раствора серной кислоты и затем по каплям добавлять раствор пероксида водорода до обесцвечивания раствора в пробирке. Испытать тлеющей лучинкой выделяющийся газ. Написать уравнение реакции, пользуясь методом электронно-ионного баланса.
Опыт 4: Внутримолекулярное окисление-восстановление.
На керамическую плитку поместить 1-2 г кристаллов бихромата аммония и прикоснуться к нему сильно нагретым в пламени спиртовки кончиком стеклянной палочки. Что наблюдается? Написать уравнение реакции, пользуясь методом электронного баланса.
ВОПРОСЫ САМОКОНТРОЛЯ ПО ТЕМЕ
"ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР)".
1. Какие реакции называют окислительно-восстановительными и чем они отличаются от обменных реакций?
2. В чем сущность процессов окисления и восстановления?
3. Какие простые вещества элементов периодической системы Д.И.Менделеева обладают наиболее сильными окислительными и восстановительными свойствами?
4. Назвать часто применяемые окислители и восстановители.
5. Как определяются эквиваленты окислителя и восстановителя?
6. Пользуясь таблицами стандартных окислительно-восстановительных потенциалов, определить, будут ли протекать следующие реакции:
Ag + H2SO4(разб.) ® Sn + H2SO4(разб.) ® …
Mn(OH)2 + H2O2 ® NaNO2 + O3 ® …
KМnO4 + Cr2(SO4)3 + H2SO4 ® FeSO4 + K2Cr2O7 + H2SO4 ®
Для тех, которые будут протекать, написать уравнения реакций.
7. Написать уравнения реакций, пользуясь методом электронно-ионного баланса:
SO2 + Br2 + H2O ® FeCl3 + H2S ®
As2S3 + HNO3(конц.) ® K2Cr2O7 + H2S + H2SO4 ®
H2O2 + CaOCl2 ® NO2 + Ca(OH)2 ®
SnCl2 + Na2SO3 + HCl ® Zn + HNO3(очень разб.) ®
Fe + HCl ® Cl2 + KOH ®
8. Написать уравнения реакций, пользуясь методом электронного баланса:
NH3 + O2 ® KМnO4 ®
(NH4)2Cr2O7 ®
9. В 1 л раствора содержится 8 г хлорной кислоты. Вычислить ее нормальность в реакции с:
а) едким натром, б) сернистым газом.
10. 0,8 г раствора пероксида водорода выделили из подкисленного раствора иодида калия 0,3 г йода. Вычислить процентную концентрацию раствора пероксида водорода.
11. Сколько мл 5%-ного раствора йодноватой кислоты (плотность 1,02) потребуется для окисления 40 мл 8%-ного раствора йодистоводородной кислоты (плотность 1,06)?
12. Сколько грамм нитрита калия можно окислить 30 миллиграммами 0,02н. подкисленного раствора перманганата калия?
13. Какие объемы сероводорода и сернистого газа (н.у.) должны прореагировать, чтобы получилось 100 кг серы?
Перечень вопросов для подготовки к экзамену
По курсу «Общая химия».
1. Основные понятия и законы стехиометрии. Атомные и молекулярные массы. Моль. Постоянная Авогадро.
2. Закон эквивалентов. Фактор эквивалентности. Атомные и молярные массы эквивалентов.
3. Периодический закон. Периодическая система элементов Д.И.Менделеева. Физический смысл номера периода и группы. Правила Клечковского.
4. Развитие представлений о сложной структуре атома. Явление радиоактивности. Модели атома. Атомные спектры.
5. Нахождение электрона в атоме. Постулаты Бора. Уравнение Шредингера. Волновая функция.
6. Представление об электроне как о частице и волне. Принцип неопределенности Гейзенберга, уравнение волны Де-Бройля. Электронное облако.
7. Заполнение электронных оболочек в атомах. Принцип наименьшей энергии, принцип Паули, правило Гунда (Хунда), правила Клечковского. Привести примеры.
8. .Квантово-механическая теория строения атома. Квантовые числа. Форма и ориентация орбиталей. Принцип Паули. Правило Хунда.
9. s-, p-, d-элементы, их валентные электроны. Энергия ионизации, сродство к электрону. Электроотрицательность.
10. Основные типы химической связи. Отличительные особенности ионной связи от других связей (ковалентной, металлической). Существует ли в природе чистая ионная связь. Когда химическая связь считается ионной? Приведите примеры соединений с ионной связью.
11. Обменный и донорно-акцепторный механизм образования ковалентной связи. Понятие валентности.
12. Теория гибридизации. Виды гибридизации. Примеры. В чем ограниченность данной теории.
13. Основные положения теории гибридизации. Как теория гибридизации объясняет пространственное строение молекул (на примере молекулы аммиака)?
14. Направленность ковалентной связи. Перекрывание негибридных орбиталей. Изобразить перекрывание орбиталей в предложенных молекулах.
15. Основные характеристики связи: длина, энергия, валентные углы. Полярность связи. Дипольный момент связи.
16. Скорость химической реакции. Зависимость константы реакции от энергетического и стерического факторов. Понятие об активном комплексе. Энергия активации.
17. Скорость химических реакций. Константа скорости. Факторы, влияющие на скорость реакции. Влияние температуры. Правило Вант-Гоффа.
18. Скорость химической реакции. Физический смысл константы скорости реакции. Ее зависимость от температуры. Правило Вант-Гоффа.
19. Обратимость химических реакций. Закон действия масс. Константа равновесия.
20. Константа равновесия в реакции гидролиза. Факторы, влияющие на равновесие реакции гидролиза. Пояснить на примерах.
21. Катализаторы и ингибиторы. Механизм их действия
