Гетроциклы с одним атомом азота.

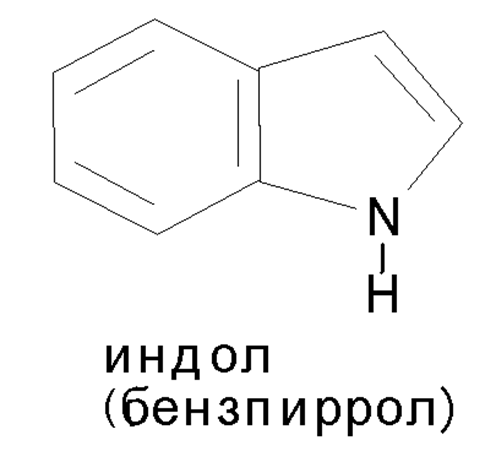
Индол встречается в природе в виде различных соединений, обладающих биологической активностью, к числу их принадлежит входящая в состав белков α–аминокислота – триптофан.
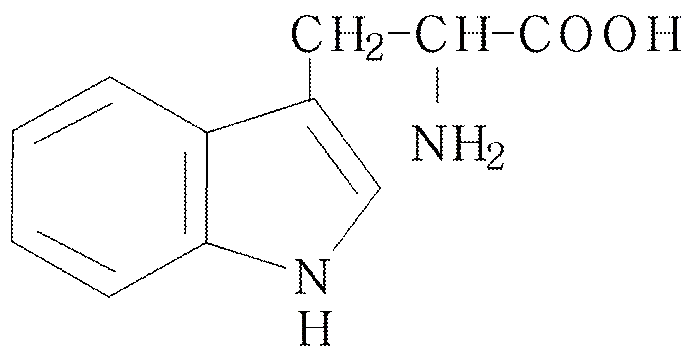
который при декарбоксилировании образует гистамин.
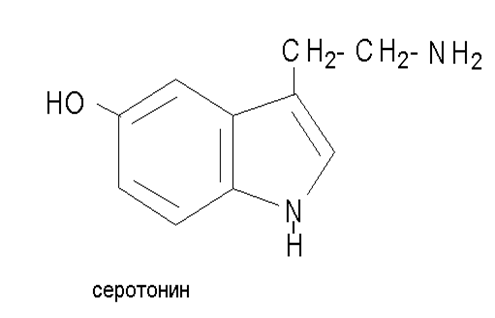
Серотонин является нейромедиатором головного мозга
Пиридин и конденсированная система пиридина и бензола, безпиридина -(хинолина) в ряду их разнообразных производных составляют большую группу лекарственных средств. В качестве отдельных примеров можно привести никотиновую кислоту и никотинамид. 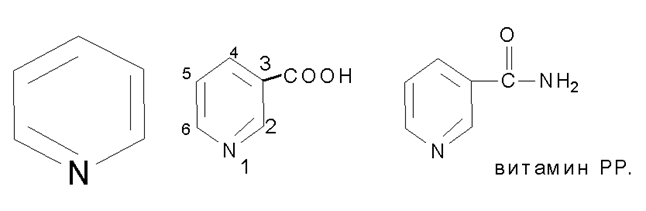

Пиридиновое кольцо входит в состав пиридоксальфосфата и НАД+.
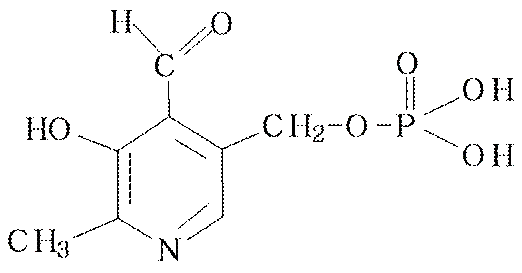
Витамин В6
Лекарственные средства на основе изоникотиновой кислоты- тубазид, фтивазид ,хинолина-оксин ,5-нок,энтеросептол.
Гетероциклы с 2-мя атомами азота
Важнейшими из которых являются пиразол, пиримидин, имидазол. Пятичленые гетероциклы с 2 гетероатомами: пиразол и имидазол являются структурными изомерами и близки по химическим свойствам.
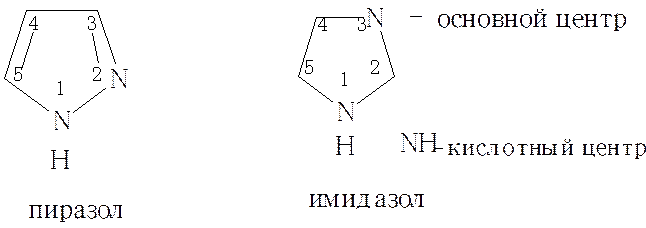
Образуют межмолекулярные водородные связи. По этой причине имидазол имеет аномально высокую температуру кипения. Имидазол участвует в кислотно-основном катализе и в реакциях SN
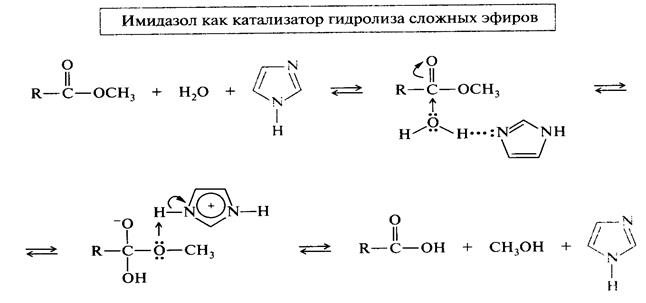
Следствием такой ассоциации является быстрый водородный обмен, который в свою очередь является причиной прототропной таутомерии у производных этих гетероциклов, а также конденсированного гетероцикла пурина. Поэтому, например, у имидазола положение 1 и 3, а у пурина положения 7 и 9 равноценны. Замещение в NH-группе водорода, устраняет возможность таутомерии.

Имидазольное ядро является структурным фрагментом гистидина, которая при декарбоксилировании образует биогенный амин– гистамин, который отвечает за аллергические реакции организма. 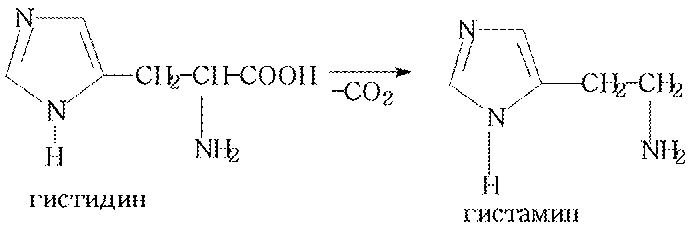 Приразол и его производные в природе не встречаются, но на его основе синтезированы известные анальгетики - антипирин, амидопирин, анальгин.
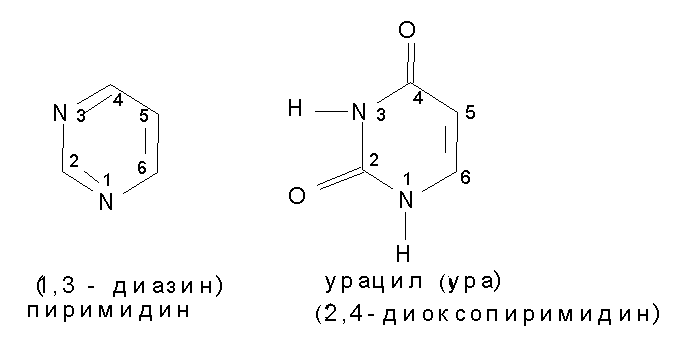
Приразол и его производные в природе не встречаются, но на его основе синтезированы известные анальгетики - антипирин, амидопирин, анальгин. 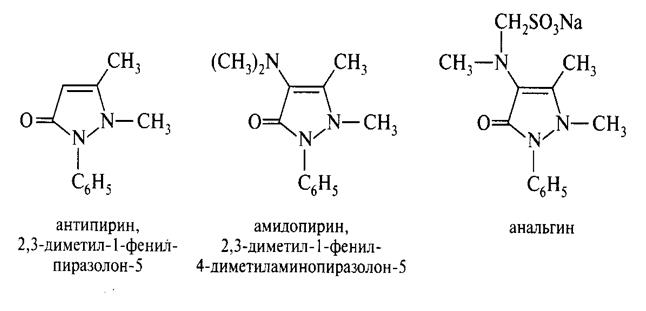 Шестичленные гетероциклы с двумя атомами азота. Пиримидин – в виде производных широко распространён в природе. Пиримидиновое ядро лежит в основе входящих в состав нуклеиновых кислот гетероциклических пиримидиновых оснований .
Шестичленные гетероциклы с двумя атомами азота. Пиримидин – в виде производных широко распространён в природе. Пиримидиновое ядро лежит в основе входящих в состав нуклеиновых кислот гетероциклических пиримидиновых оснований .
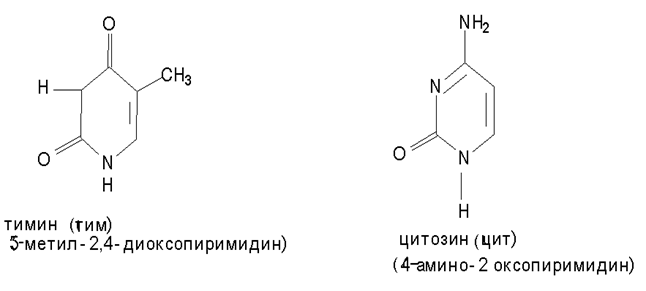
Пуриновые основания
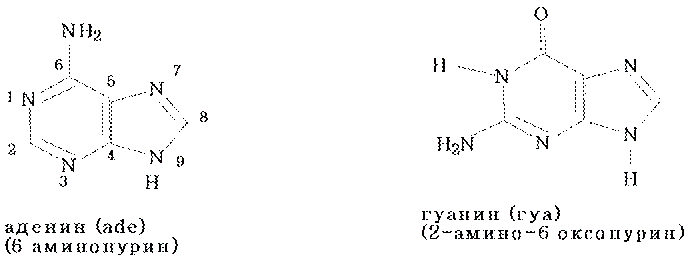
Именно в этих формах они входят в состав нуклеиновых кислот.
РНК включает ДНК включает
Урацил тимин
Ц, А, Г Ц, А, Г
Урацил, тимин, цитозин – твёрдые высокоплавкие вещества растворимые в воде и не растворимые в неполярных растворителях. Для них характерно наличие прочных межмолекулярных связей. Например:
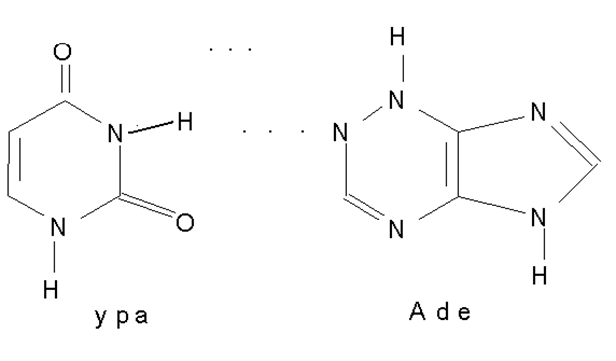 Такого рода ассоциация играет важную роль в формировании структуры нуклеиновых кислот.
Такого рода ассоциация играет важную роль в формировании структуры нуклеиновых кислот.
Гидроксипроизводные пиримидина. Барбитуровая кислота (2, 4, 6 - тригидроксипиримидин). Для них характерны как кето–енольная, так и лактим–лактамная таутомерия.
Термодинамически более устойчивой является лактамная форма. Барбитуровая кислота сильнее уксусной.
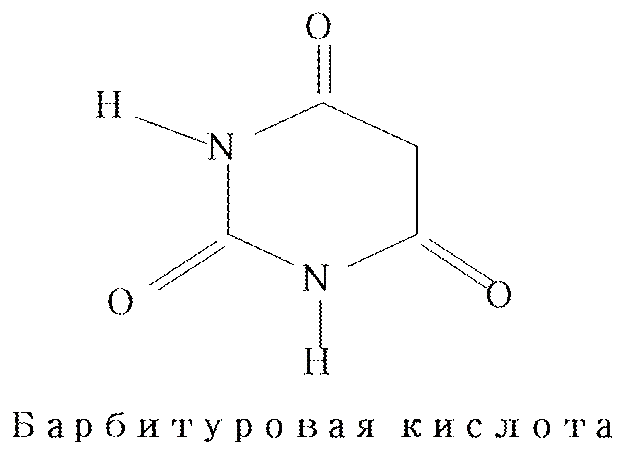
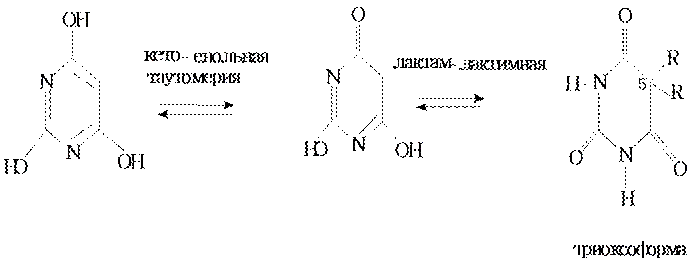
Производные барбитуровой кислоты, содержащие заместитель в положении 5 называется барбитуратами и применяется как снотворные средства. Для барбитуратов свойственно лактам – лактимная таутомерия.
Гидроксипризводные пурина. В этой группе имеется моно-, ди- и тригидроксипроизводные все они являются продуктами превращения нуклеиновых кислот в организме. Для них возможно лактим–лактамная таутомерия и прототропная таутомерия, связанная с переходом атома водорода с положения 7 к положению 9 и наоборот. В кристаллическом виде эти производные существуют преимущественно в лактамной форме.
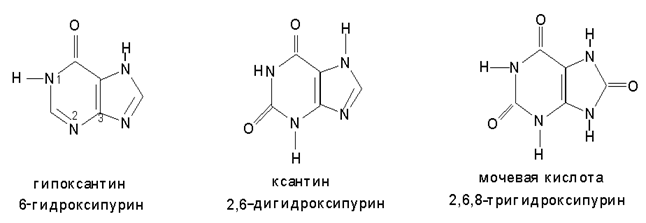
Мочевая кислота является конечным продуктом метаболизма пуриновых соединений организма. Как кислота она двухосновная. Соли называются уратами, они могут образовываться в суставах.
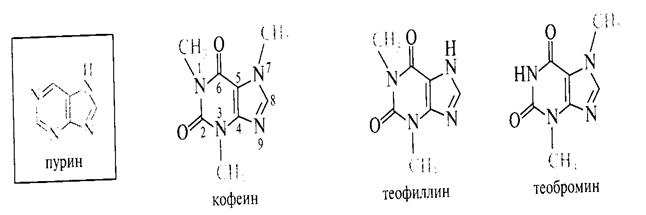
Метилированные ксантины. В медицине находит применение N- метилированные ксантины – теофилин, теобромин, кофеин они составляют группу пуриновых алкалоидов. Алкалоиды это гетерофункциональные азотсодержащие соединения растительного происхождения. Алкалоидам присуща сильная физиологическая активность. Теофиллин содержится в листьях чая, теобромин в бобах какао, кофеин в зёрнах кофе. Теофиллин и теобромин обладают мочегонными свойствами, кофеин возбуждает центральную нервную систему.
Антибиотики.
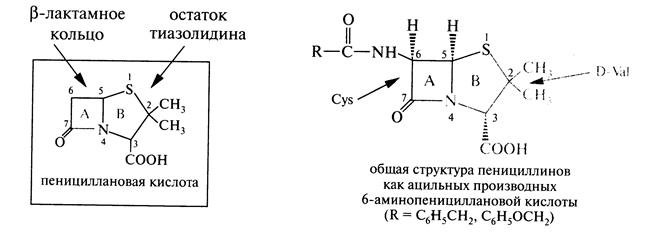
Антибиотиками называются вещества синтезируемые микро организмами и способные противостоять другим различным микроорганизмам. Открытие антибиотиков связано с именем Флеминга Флори (1929) выделил натриевую соль пенициллина (1940). Уже через 2 года получен пенициллин.
Получено более 2000 антибиотиков, только треть из них нашли применение в медицине. Большая часть из их имеет сложную гетероциклическую структуру.
Антибиотики в промышленности получают микробиологическим путём или путем, которое основано на модификации выделенной из культурной жидкости антибиотика.
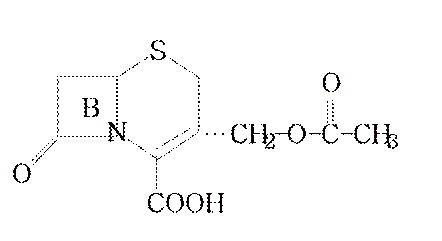
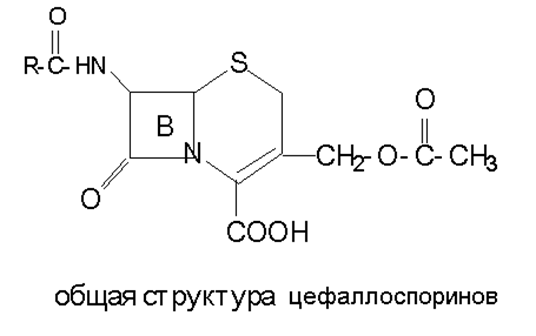
Они тормозят рост некоторых бактерий устойчивых к пенициллину.
Исследование в области антибиотиков постоянно приводят к открытию новых классов этих соединений.
Например стрептидин
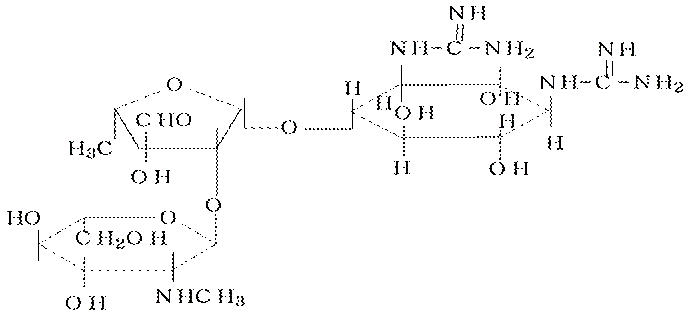
Группа аминогликозидных антибиотиков охватывает свыше 100 природных соединений.
Белковой природы грамицидин и инсулин.
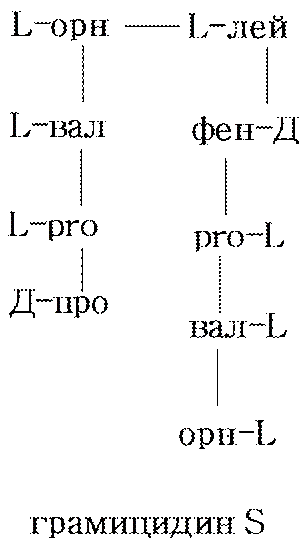
Левомицитин (синтетический антибиотик) 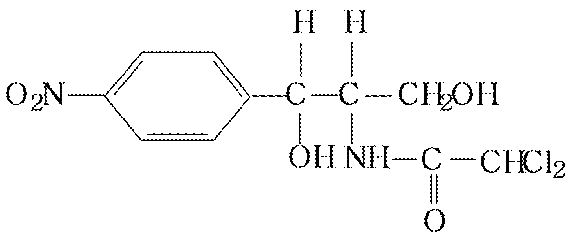
Пептиды и белки
План лекции
• Пептиды и белки. Их функции в организме
• Альфа аминокислоты структурные единицы пептидов и белков.
– номенклатура и стереизомерия альфа аминокислот.
– химические свойства альфа аминокислот.
– биологически важные реакции альфа аминокислот.
• Первичная структура белков и пептидов. Строение пептидной связи.
• Понятие о вторичной, третичной и четвертичной структуре белков.
α-аминокислоты. Пептиды (протеины).
• Пептиды и белки выполняют многие важные функции в организме. Белки составляют материальную основу химической деятельности клетки. Функции белков в природе универсальны. Среди них различают гормоны, ферменты. Белки структурные (кератин, фибрион, коллаген), транспортные (гемоглобин, миоглобин), двигательные (актин, минозин), защитные (иммуноглабулины), запасные (казеин, яичный альбумин).
• Белково-пептидную природу имеет ряд антибиотиков и токсинов .
• Пептиды и белки – ВМС построены из из остатков α-аминокислот, с которых и начнём рассмотрение данной темы.
α-аминокислоты
• С аминокислотами мы уже познакомились в теме «Гетерофункциональные соединения». Нам известно,что α-аминокислоты содержат амино- и карбоксильную группу у одного и того же атома С и отличаются строением радикала R. Аминокислоты классифицируют как: Ароматические,алифатич.,гетероциклические Заменимые и незаменимые Полярные и не полярные
• Кислые, основные и нейтральные
• Гидрофобные и гидрофильные
• Ионогенные и неионогенные
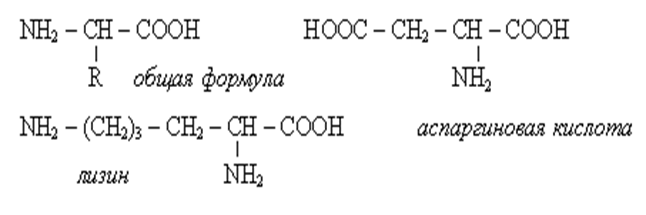
• В природных α-аминокислотах кроме одной амино- и карбоксильной группы содержатся и дополнительные функциональные группы, еще по одной NH2 или СООН, а также ОН, SH, CH3S, гетероциклические фрагменты. В природе найдено 150 аминокислот, в состав белков животного происхождения входит около 20.Н-р:
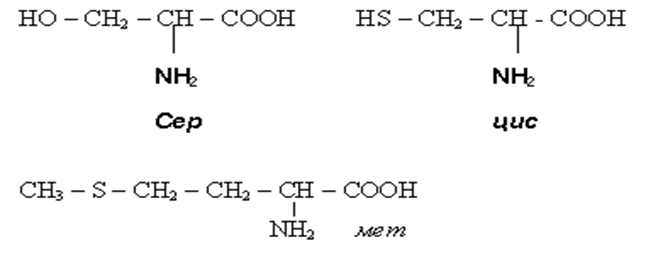
Номенклатура и стереоизомерия α - аминокислот
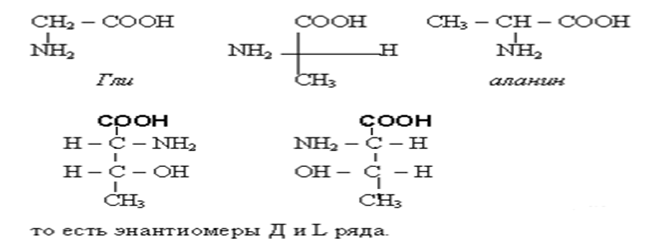
• Чаще используются тривиальные названия α-аминокислот. В записях названий сложных соединений, построенных из остатков аминокислот (пептиды, белки) применяют 3-х буквенные обозначения (обычно три первые буквы). Примеры будут даны по ходу изложения. Кроме глицина все аминокислоты имеют ассиметричный атом С,т.е имеют D и L изомеры.Изолейцин ,треонин,цистин,4-гидроксипролин имеют по два хиральных атома углерода и имеют по четыре стереоизомера.
• В белках живых организмов представлены L- аминокислоты, в белках микроорганизмов встречаются аминокислоты и Д- ряда. Д-аминокислоты нашим организмом не усваиваются.
• Биосинтез α-аминокислот осуществляется из α-кетокислот,которые являются продуктами метаболизма углеводов.
• Возможно 2 пути превращение кетонокислот в аминокислоты.
• 1) восстановительное аминирование с участием НАДН.
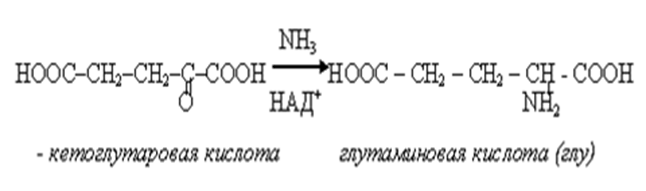
2) трансаминировние (переаминирование), когда источником группы NH2 для кетокислоты является другая аминокислота.
• Реакция протекает в присутствии кофермента пиридоксальфосфата
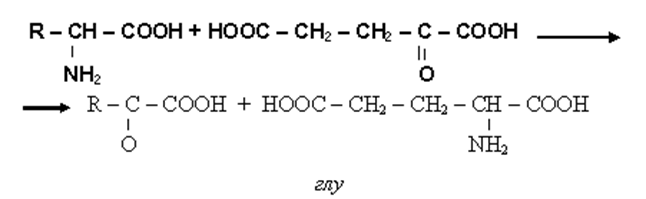
• Химические свойства. Аминокислоты амфотерные соединения, так как содержат и кислотный и основной центры, следовательно, в среде, близкой к нейтральной, они существуют в виде внутренних солей (биполярных ионов).
• Аминокислотам присущи все реакции как карбоновых кислот, так и аминов. Реакции карбоксильной группы – образование функциональных производных (сложных эфиров, амидов, ангидридов и др.). Реакции NH2-, образование солей с сильными кислотами, имидов. Одна из реакций аминов взаимодействие с HNO2 – метод количественного определения аминокислот (метод Ван-Слейка).
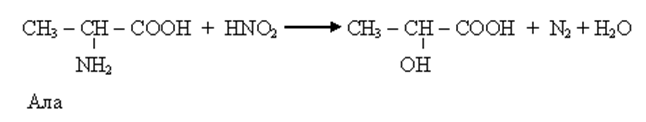
• Ряд специфических реакций обусловлен наличием СООН и NH2 у одного и того же атома С. В основном – это реакции, протекающие в организме, то есть ферментативные реакции (хотя их можно провести и вне организма). К таким реакциям относятся:
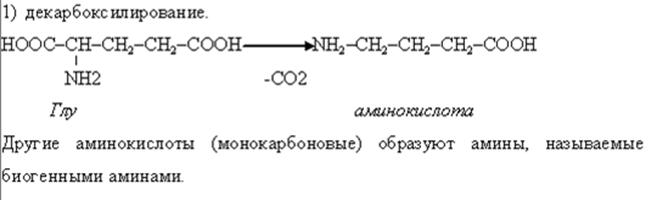
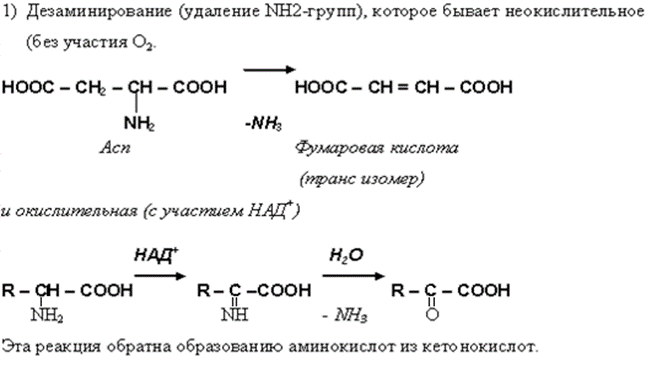
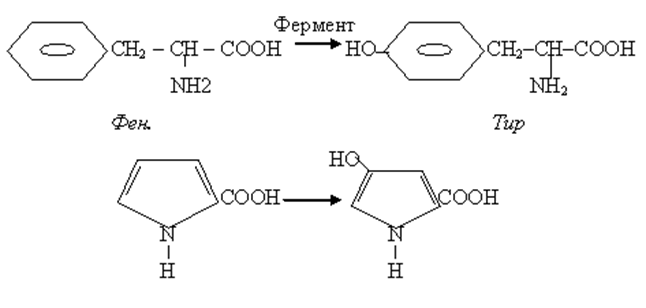
• В организме осуществляется гидроксилирование некоторых аминокислот, которые не имеют аналогов в химии IN VITRO.
• Например гидроксилирование фенилаланина с образованием тирозина и 4-гидроксипролина из пролина.
Образование замещенных амидов

Строение пептидов
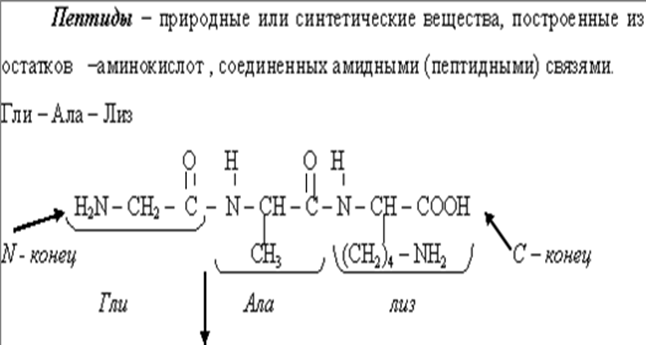
• Пептиды содержат от 50 до 100 остатков аминокислот, белки более 100. Граница деления условна. Последовательность остатков аминокислот в пептидах и белках характеризует их первичную структуру.
• Химические свойства пептидов и белков вытекают из их амидной природы: они способны гидролизоваться в кислой среде и в щелочной среде, в организме гидролиз осуществляется под действием ферментов – протеиназ.
• Гидролиз пептидов даёт сведения об аминокислотах, входящих в состав пептида. При этом необходимо учитывать, что некоторые аминокислоты частично или полностью разрушаются в условиях жесткого кислотного гидролиза. При гидролизе пептиды полностью теряется информация о порядке соединения аминокислот в цепи, то есть о первичной структуре.
• Методы определения аминокислотной последовательности (установление первичной структуры) хорошо разработаны . Это метод динитрофенилирования, метод Эдмана, дансильный метод.
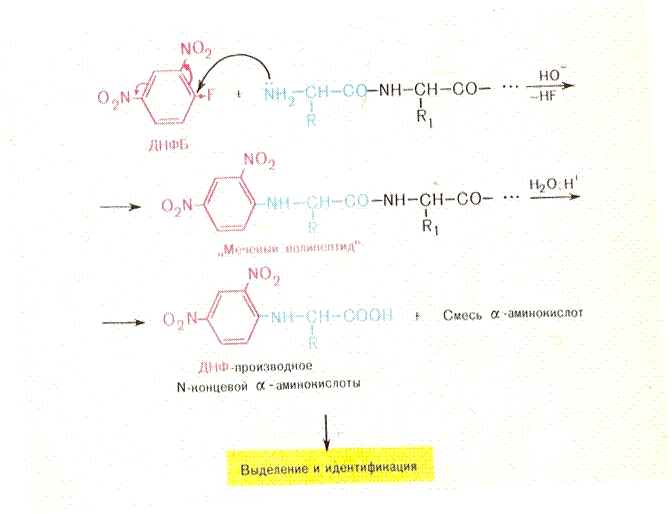
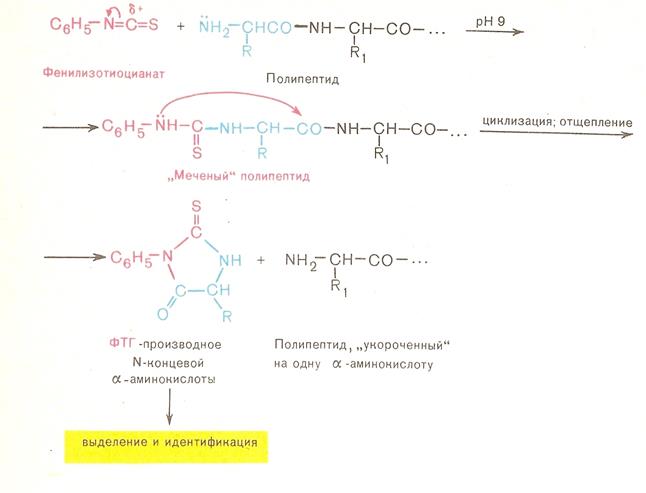
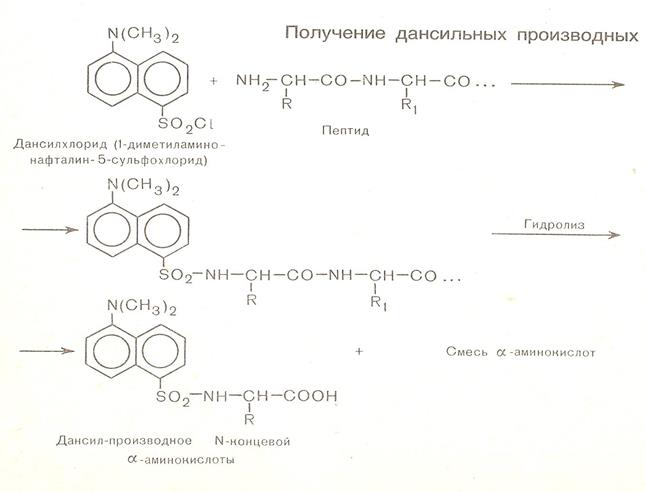
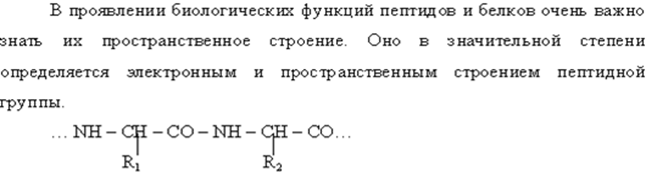
• В результате сопряженности происходит некоторое вырывание длин связей. С = 0 она удлиняется до 0,124 (0,121 нм) и укорачивание С=N сязей она равна 0,132нм вместо 0,147 нм. Наличие плоской сопряжённой системы в пептидной сязи является причиной затруднения вращения вокруг связи С – N (барьер вращения 63 – 84 кДж/моль).
• Рассмотренное строение пептидной группы предопределяет укладку всей полипептидной цепи.
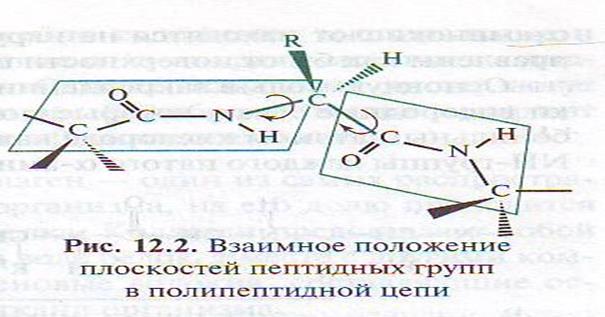
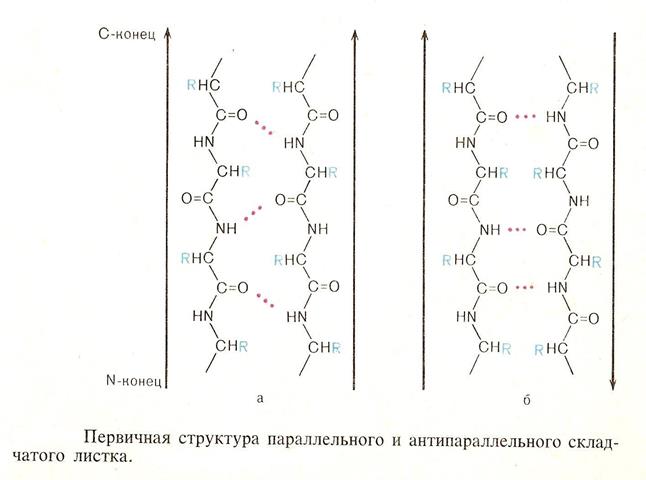
• Таким образом, кроме первичной структуры существует и вторичная структура .Пространственное расположение полипептидной цепи во вторичной структуре фиксируется водородными связями. Так отдельные участки цепи образуют α-спираль, как это было показано Полингом или β-складчатый лист.
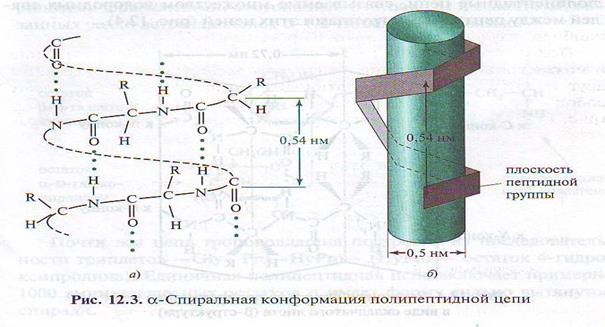
• В α-спирали на одной ветке спирали умещается 3,6 аминокислотных остатков, то есть каждая первая аминокислота связываются примерно с 5-ой по счёту аминокислотой. Например в последовательности Гли – Ала – Фен – Глу – Сер – Ала остаток Гли образует водородную связь с Сер.
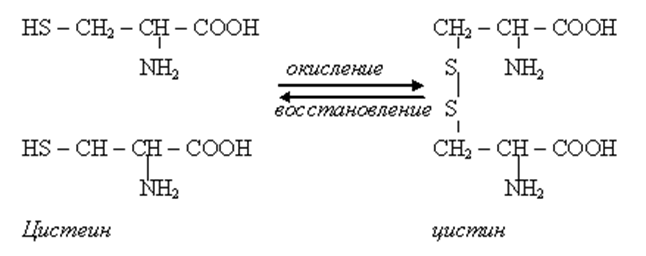
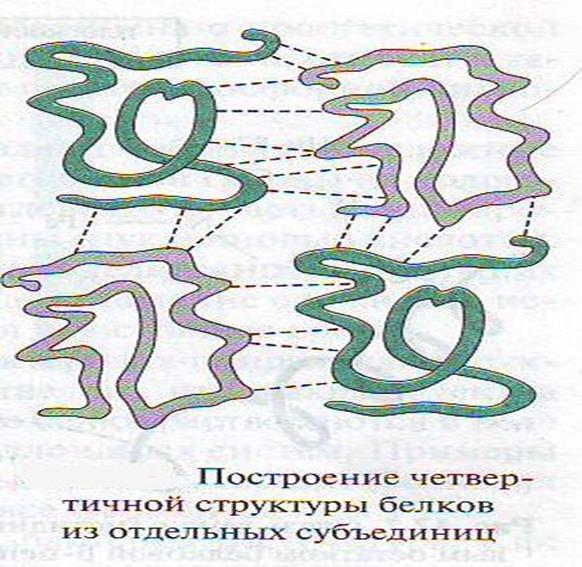
• Белки также имеют третичные и четвертичные структуры. Третичная структура стабилизирована водородными связями, ионными взаимодействия между СОО и NН3, ковалентными связями S – S за счет окисления группы SH и гидрофобными взаимодействиями ( т.е межрадикальными взаимодействиями).
УГЛЕВОДЫ
План лекции
• Углеводы и их функции. Классификация моносахаридов.
• Строение и стериоизомерия моносахаридов и их производных.
• Цикло-оксо-таутомерия моносахаридов.
• Химические свойства моносахаридов (образование O- и N- гликозидов, сложных эфиров, простых эфиров, изомеризация и эпимеризация, окисление и восстановление).
• Дисахариды, восстанавливающие и невосстанавливающие (мальтоза, целлобиоза, сахароза, лактоза).
• Гомополисахариды; крахмал, целлюлоза, гликоген, декстраны, полигалактуроновая кислота.
• Углеводы наряду с белками и липидами являются важнейшими химическими соединениями, входящие в состав живых организмов.
• Структурной основой углеводов являются моносахариды и их производные, соединенные О - гликозидными связями.
• Углеводы выполняют функции: энергетическую, структурную, защитную, а также углеводы входят в структуру ДНК и РНК и нуклеотидных коферментов.
• Углеводы - первичные продукты фотосинтеза, общую схему синтеза и метаболизма которых можно представить реакцией:
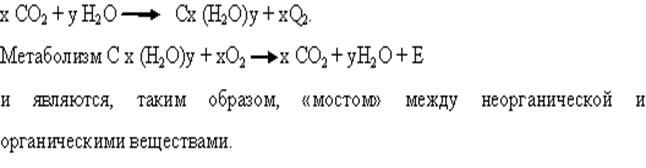
Согласно современной классификации углеводы подразделяются на три основные группы.
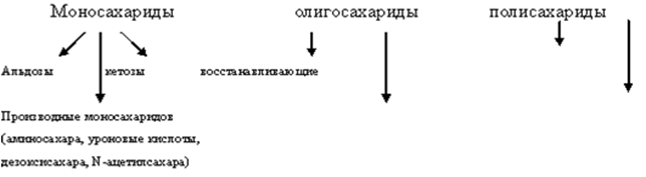
• Важнейшими из моносахаридов и их производных можно считать: Д -рибозу, Д-2-дезоксирибозу, Д-ксилозу, Д- N-ацетилксилозамин, Д-арабинозу, Д-глюкозу, Д-глюкозамин, Д-N-ацетилглюкозамин ,Д-глюкуроновую кислоту, Д-фруктозу, Д-галактозу, Д-галактозамин ,Д-маннозу.
Моносахариды
• Моносахариды классифицируются по:
• а) характеру карбонильной группы на альдозы и кетозы.
• б) по числу С в цепи на тетрозы,пентозы,гексозы. Следовательно, с учетом обоих признаков моносахариды делятся на альдопентозы, альдогексозы, кетопентозы, кетогексозы. Каждый моносахарид содержит несколько хиральных атомов С, и для них возможно существование стереоизомеров, количество которых определяется по формуле 2 в степени n .
• Моносахариды также делят на моносахариды Д ряда и L ряда.
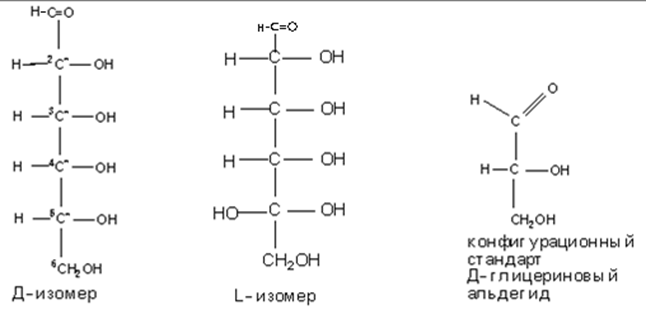
• Конкретные названия моносахаридов определяются конфигурацией всех ассиметричных атомов углерода. Отнесение к Д или L рядам проведется по конфигурации наиболее удаленного хирального атома С. В природе чаще встречаются моносахариды Д – ряда, хотя встречаются и L – ряда.
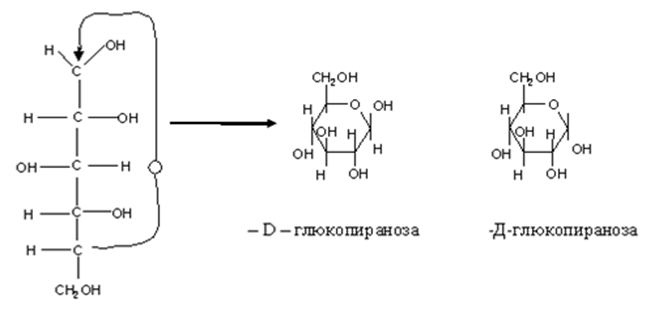
• Циклическое строение. Выше приведенным строением моносахаридов нельзя было объяснить все химические свойства моносахаридов. Это навело на мысль об ином, а именно, о циклическом строении моносахаридов. Впервые эта идея была высказана русским химиком А.А. Колли (1870) и развита позднее Б. Толленсом (1883 г.).
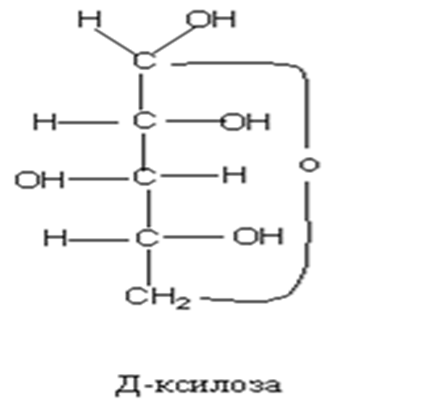
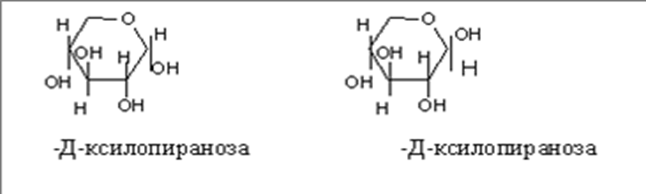
• Атом С-1 становится в результате циклизации ассиметричным ,следовательно образовавшаяся при циклизации ОН может находиться как над- так и под плоскостью цикла. Эта ОН группа называется полуацетальной (гликозидной) оба стереоизомера не являются зеркальным отражением друг друга, поэтому они диастереоизомеры и называются аномерами. Если ОН находится под плоскостью цикла, то это α- аномер, если над β-аномер.
• Циклическая полуацетальная форма может образоваться и за счет ОН группы у 4-го С ,с образованием пятичленного фуранозного цикла ,а при 5-ом пиранозного шестичленного цикла .

Рассмотрим это на примере образования фуранозных форм Д-рибозы
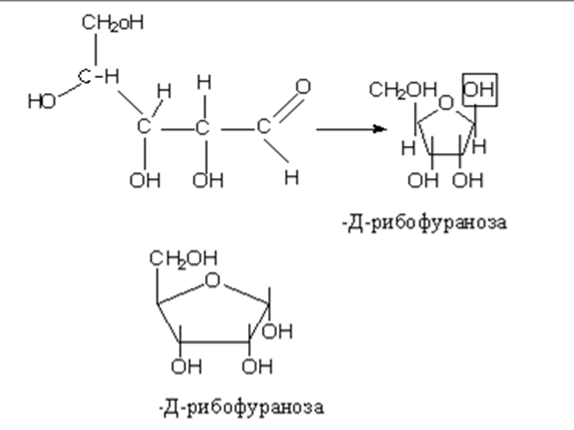
• Приведенные циклические формулы называются формулами Хеуорса (1928г.). В формулах циклический атом кислорода изображают в правом дальнем углу, атом С-1-справа. Группа ОН, которые находились в открытой форме справа располагаются над плоскостью цикла, а те, что в открытой форме были слева над плоскостью. Н-р.
Цикло-оксо-таутомерия. Так какое же строение имеют моносахариды? 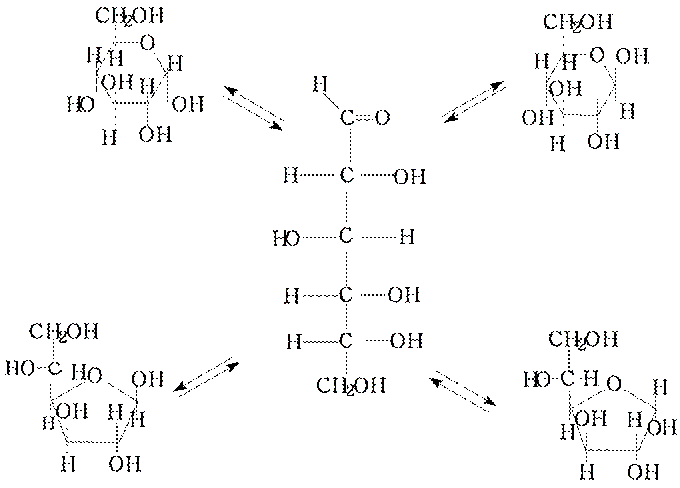
• Несмотря на незначительное содержание в открытой форме глюкозы она вступает в реакции характерные для карбонильной группы (-СОН).
• Соотношение таутомеров различное для разных моносахаридов. Более устойчивы пиранозные циклы. Так для D-глюкозы открытой формы лишь 0,003-0,03%, но через нее происходит превращение циклических форм друг в друга.
• Например α-глюкоза в воде постепенно за несколько часов дает смесь α и β-пиранозных циклов в соотношении 1:2. Из β-D – глюкопиранозы образуется смесь того же состава. Если вам удастся найти в индивидуальном виде открытую форму D-глюкозы, то и она со временем дает смесь α и β-пиранозных форм в соотношении 1:2.
• Равновесие между α и β - аномерами в формулах Хеуорса изображены волнистой линией, как это показано на примере Д-глюкуроновой кислоты.
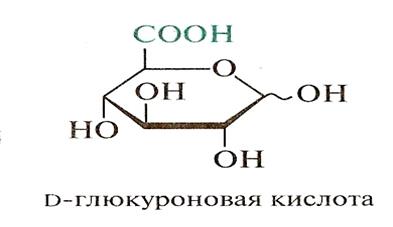
Конформационным строением объясняется соотношение α и β- пиранозных форм D-глюкозы в растворе. Таутомерное равновесие сдвинуто в сторону β-аномера, т.к.наиболее устойчивы аномеры с экваториальным расположением заместителей.

• В α-D-глюкозе СН2ОН и все ОН кроме полуацетального ОН занимают экваториальное положение. β-экваториальное положение полуацетального гидроксила в конформации моносахаридов, особенно с учетом конфигурации аномерного центра (α или β) очень важна для пространственного строения полисахаридов.
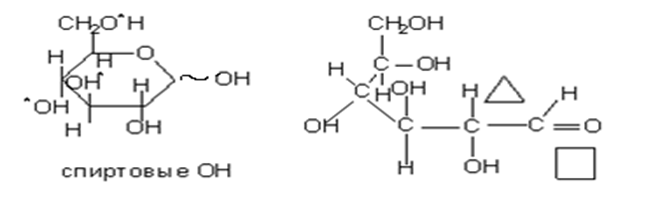
• Химические свойства. Моносахариды весьма реакционноспособные соединения вследствие их поли- и гетерофункциональности. Свойства моносахаридов можно рассматривать как свойства :
• Полуацетального гидроксила(образование О- и N-гликозидов)
• Cпиртовых гидроксилов(образование простых и сложных эфиров и фосфатов)
• Свойства карбонильной группы(окисление и восстановление)
• Свойства С-Н кислотного центра(эпимиризация и изомеризация)
• Аналогично взаимодействиям карбонильных соединений со спиртами в присутствии Н+ и без Н2О моносахариды образуют полуацетали называющиеся гликозидами. Например:
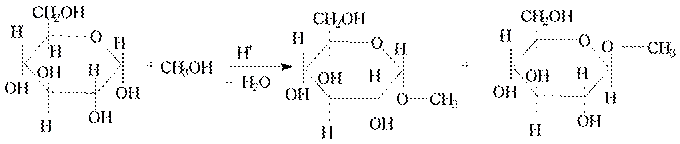
Метил- α-и-β-D-глюкопиранозиды
Смесь можно изобразить одной формулой
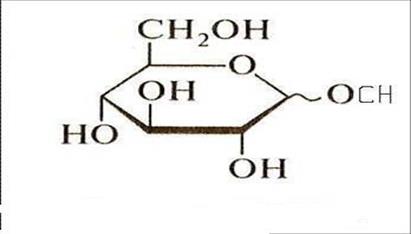
• Это знакомая реакция нуклеофильного замещения. Механизм ее аналогичен образованию обычных ацеталей. Роль Н+ заключется в превращении ОН- из плохо уходящей в хорошо уходящую группу Н2О.
• Но, а как в организме образуется гликозиды в присутствии сильных кислот да еще в безводной среде?. В iп vivo для этой цепи используются фосфаты или чаще нуклеозиддифосфат сахара.
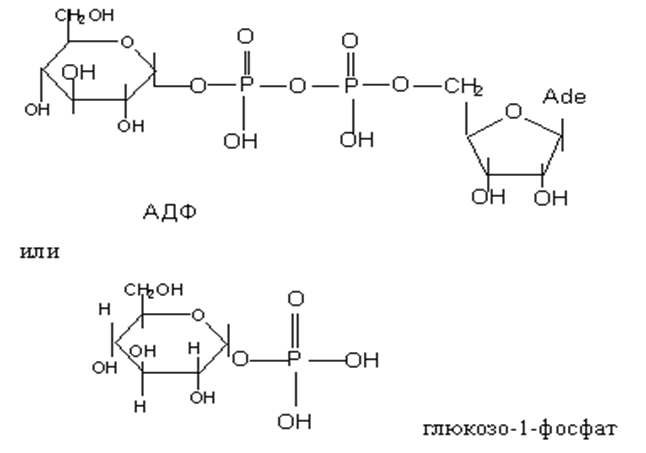
• В организме моносахариды образуют гликозиды за счет спиртовых ОН групп самих же моносахаридов и полуацетального гидроксила. При таких взаимодействиях образуюся олиго- и полисахариды.
• Кроме того, в организме происходит образование гликозидов D-глюкуроновой кислоты с некоторыми токсинами, и фенольными соединениями. Эти гликозиды выводятся из организма с мочой и осуществляется тем самым детоксикация.
• Гликозидам родственны их азотсодержащие соединения, которые называются N-гликозидами.N- гликозиды являются компонентами РНК и ДНК.
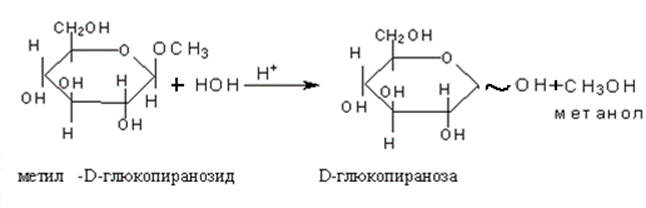
• Важнейшее свойство гликозидов это способность подвергаться гидролизу в кислой среде и достаточная устойчивость к гидролизу в щелочной среде.
• Гидролиз гликозидов – реакция обратная их образованию.
Реакции спиртовых ОН-групп: образование сложных и простых эфиров.
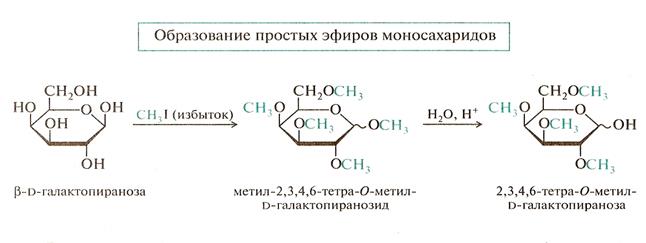
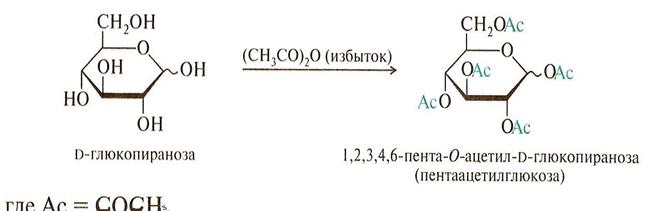
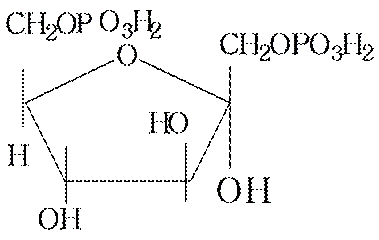
• В биологических превращениях моносахаридов важную роль играют фосфаты (сложные эфиры фосфорной кислоты с моносахаридами) например фруктоза-1,6- дифосфат
• Свойства сложных эфиров моносахаридов, как и всех сложных эфиров-способность гидролизоваться в кислой и щелочной средах до кислоты и моносахарида.
• Спирты, как известно, могут окисляться, образуя карбоновые кислоты, причем первичные спирты окисляются легче вторичных. Но при окислении надо помнить, что в их молекуле есть еще легче окисляемый атом С-1 (СОН группа). При необходимости окислить только ОН при С-6 «защищают» СОН-группу.
• В организме подобной защитой являются 1-фосфатная группа
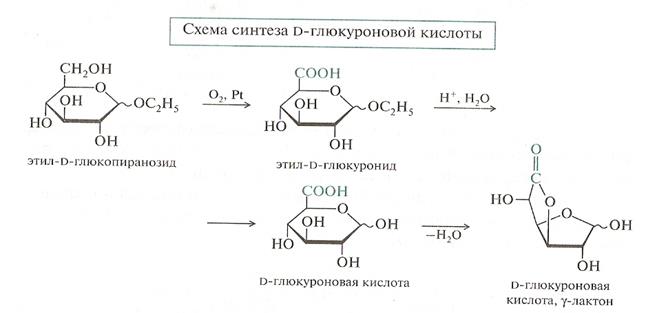
Реакции окисления
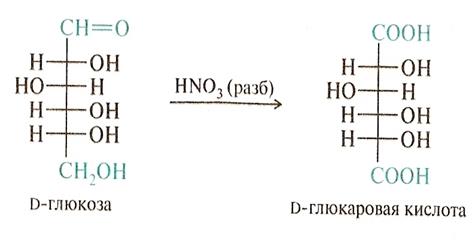
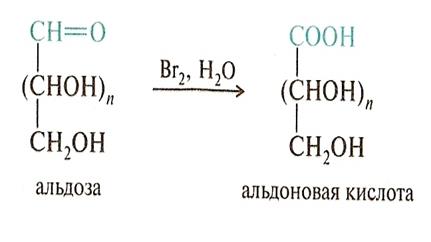
• Мягкое окисление альдоз превращает альдегидную группу в карбоксильную и приводит к альдоновым кислотам,а окисление более жестких условиях приводит к гликаровым кислотам.
Реакции карбонильной группы
• Несмотря на то, что доля открытой формы моносахарида в таутомерной смеси очень мала, некоторые качественные реакции на альдегидную группу дают возможность использовать их в аналитических целях. Это реакции восстановления ионов меди (II) и серебра. В этих реакциях моносахариды проявляют восстановительные свойства. Надо отметить, однако, что реакция «серебряного зеркала» редко используется для анализа моносахаридов, т.к. в нее вступают не только альдегиды, но и многие другие соединения.
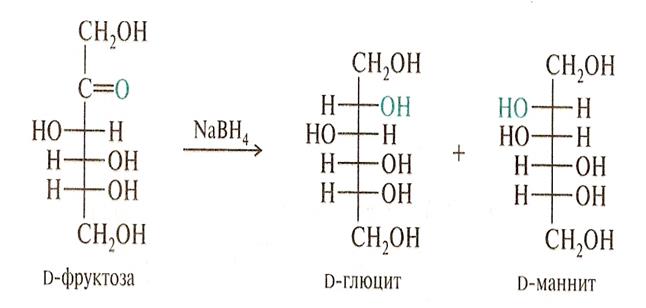
• Восстановление карбонильной группы в спиртовую приводит к альдитам (сахарным спиртам). Некоторые из них, например, ксилит (продукт восст. D-ксилозы) и сорбит ( продукт восст. D- глюкозы), используют как заместители сахара при сахарном диабете.
Альдиты не вовлекаются в биохимический цикл превращения моносахаридов, т.к. не являются моносахаридами.Пример восстановления фруктозы: