Структура периодической системы
Наиболее распространённой является «короткая» (короткопериодная форма таблицы). В «короткой» форме записи в четвёртом и последующих периодах занимают по 2 строчки; символы элементов главных и побочных подгрупп выравниваются относительно разных краёв клеток:
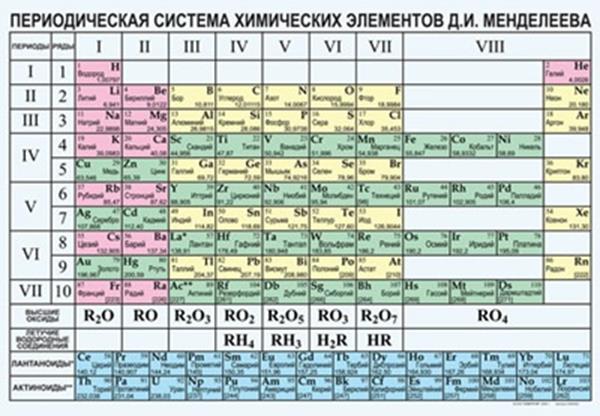
Периоды— это горизонтальные ряды химических элементов. Каждый период начинается щелочным металлом (Li, Na, K, Rb, Cs, Fr) и заканчивается инертным газом (He, Ne, Ar, Kr, Xe, Rn). Исключения составляют первый период (он состоит из двух элементов — водорода и гелия) и седьмой период (он не закончен). Первые три периода называются малыми, четвертый, пятый, шестой и седьмой периоды — большими.Номер периода равен числу энергетических уровней. В атомах всех известных элементов электроны заполняют от 1 до 7 энергетических уровней и периодическая система состоит из семи периодов.
Группы— это вертикальные ряды элементов, атомы которых имеют похожие свойства. Группы имеют нумерацию римскими цифрами от I до VIII с добавлением латинских букв А или В (подгруппы). Подгруппы А часто называют главными, подгруппы В называют побочными. В подгруппе А атомы элементов имеют одинаковое число электронов на внешнем энергетическом уровне и это число равно номеру группы. В погруппе В атомы d-элементов имеют одинаковое суммарное число электронов на d-подуровне предвнешнего слоя и s-подуровне внешнего слоя. Это число также равно номеру группы.
Например:
Атомы элементов IV B группы
22Ti 1s22s22p63s23p64s23d2
40Zn…3s23p64s23d104p65s24d2
72Hf…4s23d104p65s24d105p66s25d2
Атомы элементов VI В группы
24Cr 1s22s22p63s23p64s13d5
41Mo…3s23p64s23d104p65s14d5
74W…4s23d104p65s24d105p66s15d5
Последовательность заполнения энергетических уровней и подуровней определяет деление химических элементов на s-, p-, d- и f-блоки или семейства. s-Блок объединяет две группы: IА — щелочных и IIA — щелочноземельных металлов. В качестве валентных электронов выступают электроны s-орбиталей. Поэтому элементы этих групп называют s-элементами. р-Блок объединяет 6 групп: IIIА–VIIIА — неметаллов, амфотерных и благородных металлов. Валентными электронами в этом блоке являются электроны р-рбиталей и элементы этих групп называют р-элементами. d-Блок объединяет восемь групп IIIВ–VIIIВ, IВ и IIВ комплексообразующих переходных элементов. У них валентными электронами являются, как правило, электроны s- и d-орбиталей. Соответственно элементы этих групп называют d-элементами.В периодическую таблицу также входят f-блоки лантанидов (лантаноидов) и актинидов (актиноидов). Элементы f — блока называются f-элементами и располагаются в нижней части периодической системы. При написании электронных конфигураций атомов, надо знать, что каждый период начинается двумя s-элементами (ns-элементы) и заканчивается шестью р-элементами (nр-элементы), где n — номер периода. В четвертом и пятом периодах между s- и р-элементами вклинивается
10(n – 1)d-элементов. Заполнение d-подуровня запаздывает на один период. В шестом и седьмом периодах после s-элементов следует 10(n – 1)d-элементов и 14(n – 2)f-элементов. Заполнение f-подуровня запаздывает на два периода.
Атомные и ионные радиусы
С точки зрения квантовой механики атом не имеет строго определенных границ, поэтому установить его абсолютные размеры невозможно. В химической практике наиболее широко используются эффективные(т. е. проявляющие себя в действии) радиусыатомов, рассчитанные по межъядерным расстояниям в молекулах и кристаллах. Необходимо различать радиусы атомов в соединениях с ковалентной, металлической и ионной связями. Ковалентные и металлические радиусы по смыслу отвечают понятию «атомный радиус». Ковалентный радиус— это половина межъядерного расстояния в молекулах или кристаллах простых веществ. Металлический радиустакже равен половине расстояния между центрами двух соседних атомов в кристаллической решетке металла. Эффективные радиусы, рассчитанные для кристаллов с преимущественно ионным типом связи, получили название ионных радиусов. Различают радиусы положительных ионов (катионов) и отрицательных ионов (анионов). Радиусы катионов всегда меньше атомных радиусов соответствующих элементов, а радиусы анионов больше атомных радиусов. Радиус атомов уменьшается в периодах слева направо с увеличением заряда ядер атомов. В группах с ростом заряда ядер радиусы атомов увеличиваются, причем в подгруппах А увеличение происходит в большей степени, чем в подгруппах В.Уменьшение радиуса атомов в ряду d- и f-элементов называется соответственно d- и f-сжатием, которое отражается на свойствах последующих элементов. Например, наблюдается d-сжатие у d-элементов от скандия (Sс) до цинка (Zn); f-сжатие — у f-элементов от церия (Сe) до лютеция (Lu). Радиусы атомов d-элементов шестого периода примерно равны радиусам атомов d-элементов пятого периода, поэтому d-элементы пятого и шестого периодов по свойствам очень похожи друг на друга.
Та минимальная энергия, которую надо затратить для отрыва одного электрона от атома с образованием положительного иона, называется энергией ионизации.Э → Э+ + ē
Энергия ионизации характеризует восстановительные свойства элемента. Чем меньше энергия ионизации ( I ), тем больше восстановительные свойства элемента. Энергия ионизации определяется электронным строением элементов и увеличивается в периоде слева направо. Наименьшее значение энергии ионизации имеют щелочные металлы, наибольшее— благородные газы (He, Ne, Ar, Kr, Xe, Rn). С увеличением размера атома в группах сверху вниз уменьшается энергия ионизации для отрыва электрона от атома таб. 4 прил..
Сродство к электрону— это энергия, которая выделяется при захвате электрона, или энергия, которую надо затратить для присоединения электрона к нейтральному атому
Э + ē → Э-. Характеризует окислительные свойства элементов. Чем больше сродство к электрону, тем больше окислительные свойства. Сродство к электрону зависит от положения элемента в периодической системе. Наибольшие значения сродства к электрону имеют галогены, кислород, сера; наименьшие — элементы с электронной конфигурацией s2(He, Be, Mg, Zn), с полностью или наполовину заполненными р- подуровнями (Ne, Ar, Kr, N, P, As). Энергию ионизации и сродство к электрону количественно выражают или в килоджоулях на моль (кДж/моль), или в электронвальтах (эВ)
Электроотрицательность— это условная величина, которая характеризует способность атома в химическом соединении притягивать к себе электроны. Эта способность атомов зависит от типа соединений, валентного состояния элемента и имеет условный характер. Однако, использование электроотрицательности полезно для объяснения типа химических связей и свойств соединений. Имеется несколько шкал значений электроотрицательности.
Л. Полинг (США) предложил пользоваться относительными значениями электроотрицательности (см. табл. 6 прил). Он ввел относительную шкалу электроотрицательности, приняв электроотрицательность фтора, равной четырем, а электроотрицательность лития, равной единице. В периоде с увеличением заряда относительная электроотрицательность в среднем увеличивается и усиливаются неметаллические свойства. По значению электроотрицательности можно провести условное деление элементов на металлы, неметаллы и амфотерные. Если электроотрицательность равна 2, то это амфотерный элемент; если электроотрицательность меньше 2, то это металл; если электроотрицательность больше 2, то это неметалл.
