Последовательность электродных процессов
В общем случае к электродам подходит не один, а несколько видов способных к разряду частиц. В связи с этим важно уметь определить, какие же из конкурирующих процессов будут происходить на катоде и аноде в первую очередь.
На катоде протекает реакция восстановления, поэтому в первую очередь должны реагировать наиболее сильные окислители. Следовательно, на катоде, прежде всего, протекает реакция с наиболее положительным электродным потенциалом.
Соответственно, так как на аноде протекает реакция окисления, то в первую очередь должны реагировать наиболее сильные восстановители. Следовательно, на аноде, прежде всего, протекает реакция с наиболее отрицательным электродным потенциалом.
Пример 1.Напишите уравнения реакций электролиза расплава хлорида натрия. Электроды графитовые.
Решение: В расплаве хлорид натрия диссоциирует: NaCl⇄ Na+ + Cl¯
Катионы под действием электрического тока перемещаются к отрицательному электроду – катоду и восстанавливаются:
(К) Na+ + ē → Na
Анионы под действием электрического тока перемещаются к положительному электроду – аноду и окисляется:
(А) 2 Cl¯ - 2 ē → Cl2
Уравнение окислительно-восстановительной реакции процесса электролиза получается из уравнений анодной и катодной полуреакций после умножения каждого из них на соответствующий коэффициент, чтобы уравнять число отдаваемых и принимаемых электронов:
 2 (К) Na+ + ē → Na
2 (К) Na+ + ē → Na
1 (А) 2Cl¯ - 2ē → Cl2
 2 Na+ + 2ē + 2 Cl¯ - 2ē → 2 Na + Cl2
2 Na+ + 2ē + 2 Cl¯ - 2ē → 2 Na + Cl2
2 NaCl 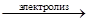 2Na + Cl2
2Na + Cl2
Пример 2.Какие реакции будут протекать на электродах при электролизе водного раствора хлорида меди с инертными электродами?
Решение: CuCl2 ⇄ Cu2+ + 2Cl¯
Следовательно, к катоду подойдут ионы Cu2+, а к аноду ионы Cl¯.
Кроме того, сама вода может восстанавливаться на катоде и окисляться на аноде. А также окисляться может сам анод – Cu.
Таким образом, на катоде всегда возможно два варианта – восстановление катионов металла и восстановление молекул H2O:
Катод:
(1) Cu2+ + 2ē = Cu
(2) 2H2O + 2ē = H2 + 2OH¯
Если идет преимущественно вторая реакция, то в прикатодном пространстве происходит образование и накопление ионов ОН¯, т.е. произойдет подщелачивание раствора, которое можно обнаружить с помощью соответствующего индикатора.
На аноде возможны 3 варианта: окисление аниона соли, окисление молекул Н2О и окисление анода:
Анод:
(1) 2Cl¯ - 2ē → Cl2
(2) 2H2O - 4ē = O2 + 4H+
(3) Cu0 - 2ē = Cu2+
Если идет преимущественно вторая реакция, то в прианодном пространстве происходит образование и накопление ионов Н +, т.е. произойдет подкисление раствора, которое можно обнаружить с помощью соответствующего индикатора.

ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. В чём заключается сущность электролиза? Какое оборудование необходимо для его осуществления в простейшем случае?
2. К какому полюсу источника тока подключают при электролизе катод? анод?
3. Электролитическое кадмирование проводили в течение 0,5 час при силе тока 20 А. Выход кадмия по току в условиях электролиза составлял 90%. Вычислите массу осажденного кадмия . Ответ: 18,87 г;
4. В какой последовательности выделяются на катоде металлы при электролизе раствора, содержащего ионы Bi3+, Au3+, Cu2+, Ag+ в одинаковой концентрации?
5. Какие процессы протекают при электролизе водного раствора КОН с платиновыми электродами?
6. Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 часа при силе тока 4А?
7. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (н.у.)?
8. Какая масса гидроксида калия образовалась у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 л кислорода (н.у.)?
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование:электролизеры, зарядные устройства, электроды, набор проводов, растворы электролитов.
