Кинетика электродных процессов. Поляризация
Равновесные потенциалы электродов могут быть определены в условиях отсутствия в цепи тока. При прохождении электрического тока потенциалы электродов изменяются. Изменение потенциалов электрода при прохождении тока называется поляризацией:
DЕ = Еi –Ep,
где DЕ – поляризация;
Еi – потенциал электрода при прохождении тока;
Ep – равновесный потенциал.
Термин «поляризация» употребляется не только для обозначения величины изменения потенциала, но и самого явления изменения потенциала при прохождении тока. Так как поляризация может наблюдаться как на катоде, так и на аноде, то различают катодную и анодную поляризацию - DЕк и DЕa.
Изменение потенциала при прохождении тока также называется перенапряжением. Этот термин обычно употребляют, когда известна причина изменения потенциала. Его также относят к некоторым конкретным процессам, например к катодному выделению водорода (водородное перенапряжение).
Для экспериментального определения поляризации строят кривую зависимости потенциала электрода от протекающего через электрод тока. Из закона Фарадея следует, что ток пропорционален количеству вещества, прореагировавшего на электроде в единицу времени, т.е. скорости электро-химической реакции. Поэтому значение тока может быть использовано для количественной оценки скорости электрохимической реакции. Так как электроды могут быть разными по площади, то в зависимости от площади электрода при одном и том же потенциале могут быть разные токи, поэтому скорость реакции относят к единице площади поверхности. Отношение тока к площади электрода называют плотностью тока i = I/S.
Графическую зависимость потенциала от плотности тока называют поляризационной кривой (рис. 4.5).
Рис. 4.5. Поляризационные кривые
двух электродов
Величину поляризации электрода можно определить по разности между потенциалом при прохождении тока Ei и равновесным потенциалом Ep. Из кривых поляризации видно, что для получения большего тока необходимо большее отклонение потенциала от равновесного значения. Таким образом, скорость электрохимической реакции может быть увеличена повышением поляризации, соответственно поляризация одного и того же электрода тем выше, чем больше плотность тока.
Скорость и механизм протекания электрохимических реакций изучает электрохимическая кинетика. Особенностью электрохимических реакций является влияние потенциала на их скорость. Любая электрохимическая реакция протекает как минимум в три стадии: подвод реагентов к электроду, собственно электрохимическая реакция (может включать и химические реакции), отвод продуктов реакции от электрода. Если бы все эти стадии протекали мгновенно, то потенциал электрода при прохождении тока не изменялся бы и соответственно поляризация была бы равна нулю. Однако все три стадии протекают с конечными скоростями, причем одна из них лимитирует всю реакцию, и для ее ускорения необходимо изменение потен-циала электрода, т.е. поляризация. Следовательно, возникновение поляризации обусловлено замедленностью отдельных стадий электрохимического процесса. Соответственно в зависимости от характера замедленной стадии на электроде возникает концентрационная или электрохимическая поляризация.
Изменение потенциала электрода вследствие изменения концентрации реагентов в приэлектродном слое при прохождении тока называется концентрационной поляризацией. В свою очередь изменение концентрации реагирующих веществ в приэлектродном слое вызывается замедленностью подвода реагентов к электроду или отвода продуктов реакции от электрода. Так как по уравнению Нернста потенциал электрода пропорционален логарифму активности ионов (в разбавленных растворах – концентрации ионов), то концентрационная поляризация должна быть пропорциональна разности логарифмов активностей (концентраций) ионов в приэлектродном слое аS и в объеме раствора аV:
DЕконц = 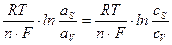 . (4.8)
. (4.8)
С увеличением плотности тока растет разность между активностями (концентрациями) в приэлектродном слое и в объеме раствора и соответственно возрастает концентрационная поляризация:
DЕконц = 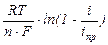 , iпр = n×F×сV×D/d, (4.9)
, iпр = n×F×сV×D/d, (4.9)
где iпр – предельная плотность тока;
cV – концентрация реагента в объеме раствора;
D – коэффициент диффузии реагента;
d - толщина диффузного слоя.
Как видно из уравнений (4.8) и (4.9), концентрационная поляризация снижается с увеличением коэффициента диффузии и концентрации реагента и уменьшением толщины диффузионного слоя. Диффузионным слоем называется тонкий слой около поверхности электрода, в котором происходит перемешивание жидкости (отсутствие конвекции) и соответственно молекулы переносятся лишь путем диффузии. Толщина этого слоя, а также концентрационная поляризация уменьшаются при перемешивании жидкости (раствора). На рис. 4.6 приведены типичные кривые зависимости «потенциал-плотность тока» для концентрационной поляризации.
Изменение потенциала, обусловленное замедленностью собственно электрохимических стадий реакций, называется электрохимической поляризацией (перенапряжением). Замедленность электрохими-ческих стадий объясняется существенной перестройкой структуры реагирующих частиц в ходе реакции. Как и при химической реакции, электрохимические процессы происходят лишь тогда, когда реагирующие частицы обладают энергией, которая больше или равна энергии активации.
Рис. 4.6. Кривые «потенциал-плотность тока»
при концентрационной поляризации с
перемешиванием (1) и без перемешивания (2)
Скорость электрохимических реакций, как и химических, может быть увеличена повышением температуры и применением катализатора. Энергия активации может быть снижена при изменении потенциала электрода по сравнению с его равновесным потенциалом, т.е. при поляризации. Так как при уменьшении энергии активации растет скорость реакции, то увеличение поляризации приводит к ускорению электрохимической реакции и к повышению плотности тока. Связь между электрохимическим перенапряжением DЕЭЛ и плотностью тока выражается уравнением Тафеля
DЕЭЛ = а +в×lgi.
Константа в зависит от природы реакции и от температуры и при 298 К лежит в пределах 0,03…0,15. Константа а зависит от природы реакции, материала электрода, состава раствора и температуры.
Электрохимическая поляризация уменьшается с уменьшением температуры и концентрации реагента и не зависит от перемешивания раствора.
5. ВИДЫ коррозии
Химическая коррозия
Химическая коррозия представляет собой самопроизвольное разрушение металлов и их сплавов в газовых средах или жидких неэлектролитах. Химическая коррозия возможна только в условиях, исключающих протекание электрохимических процессов, и ее характерной особенностью является отсутствие на поверхности металла влаги. Поэтому в большинстве случаев речь идет о коррозии при повышенной температуре, при которой вода находится в газовой фазе. Однако, исходя из определения, газовая коррозия возможна и при комнатной температуре в условиях высокой степени сухости, естественной или созданной искусственно. В промышленности газовая коррозия встречается достаточно часто - от разрушения деталей нагревательных агрегатов до коррозии верхних поясов резервуаров.
В среде чистого воздуха коррозия сводится к взаимодействию металла с кислородом, т.е. к окислительно-восстановительной реакции, осуществляемой непосредственным переходом электронов металла на окислитель.
Уравнение реакции окисления металлов кислородом можно записать в общем виде как
nM + 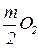 = MnOm. (5.1)
= MnOm. (5.1)
В соответствии с законами химической термодинамики эта реакция, как и другие реакции коррозии, может протекать лишь при условии уменьшения энергии Гиббса системы, т.е. при условии DG < 0. Так как по определению энергия Гиббса образования простых веществ равна нулю, то энергия Гиббса окисления металлов равна энергии Гиббса образования оксидов. Энергию Гиббса окисления рассчитывают по уравнению
DG = DG°- 
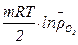 , (5.2)
, (5.2)
где 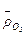 - относительное парциальное давление кислорода (р/100).
- относительное парциальное давление кислорода (р/100).
Для подавляющего большинства металлов стандартная энергия Гиббса их окисления ниже нуля, что говорит о возможности протекания этой реакции при атмосферном давлении кислорода. Для большинства металлов условие, при котором коррозия невозможна, выполняется при очень низких давлениях. Однако энергия Гиббса меняется при изменении температуры, и соответственно меняется и давление кислорода, при котором DG > 0.
Скорость химической коррозии зависит от многих факторов, и в первую очередь от характера продуктов коррозии. В процессе окисления на поверхности металла образуется твердая пленка оксидов. Для продолжения коррозии необходимо, чтобы ионы металла или кислород, или оба вместе диффундировали через эту пленку. Обычно с поверхности раздела «металл-оксид» в направлении от металла к внешней поверхности пленки происходит диффузия ионов металла, а не атомов металла, так как ионы металлов по размерам меньше атомов. Одновременно в этом же направлении должны перемещаться электроны. Ионы О2- имеют больший радиус, чем атомы, поэтому с поверхности раздела «оксид-газ» в глубину пленки двигаются не ионы, а атомы кислорода, которые в пленке ионизируются (О + 2е = О2) и, встречаясь с ионами металла, образуют окислы.
Скорость окисления определяется сплошностью и защитными свойствами поверхностной пленки и зависит от наличия в ней трещин и пр. Поскольку пленки продуктов коррозии обычно хрупки и малопластичны, образование трещин, в известной степени, зависит от того, претерпевает ли пленка в процессе роста деформации, способствующие ее растяжению, или же она образуется в условиях сжатия. Это, в свою очередь, зависит от соотношения между объемами продуктов коррозии и металла, из которого она образовалась.
Пиллингом и Бедворсом условие сплошности окисной пленки было сформулировано в следующем виде: если объем окисла металла меньше, чем объем металла, из которого пленка образовалась, то пленка образуется несплошной, если объем окисла металла больше, чем объем металла, то пленка может быть беспористой, компактной.
Сказанное можно пояснить следующими неравенствами: при 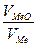 < 1 пленка не может быть сплошной; при
< 1 пленка не может быть сплошной; при 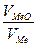 > 1 пленка может быть сплошной.
> 1 пленка может быть сплошной.
В свою очередь
VМе = 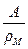 и VМеО =
и VМеО = 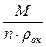 , (5.3)
, (5.3)
где А – атомный вес металла;
rМ – плотность металла;
М – молярная масса окиси металла;
n – число атомов металла в молекуле окиси;
rок – плотность окиси.
Условие сплошности является необходимым, но не единственным для характеристики свойств окисной пленки. При слишком больших значениях VМеО / VМе пленка испытывает столь высокие внутренние напряжения, что разрушается, теряя сплошность.
Толщина пленки пропорциональна времени окисления:
d = К×t + А, (5.4)
где d – толщина пленки;
А – постоянная;
t – время окисления;
К – скорость коррозии.
Постоянная А указывает на наличие некоторой окисленной пленки к моменту начала окисления (d = А при t = 0). Как следует из уравнения (5.4), скорость К роста пленки в этом случае не зависит от ее толщины. Коррозия может протекать с постоянной скоростью вплоть до полного превращения металла в окисел. Однако нередко фактическая скорость окисления, сохраняя постоянство, оказывается ниже теоретической скорости химической реакции окисления металла. Это несоответствие объясняется наличием на границе раз-дела «металл-окисел» металла тончайшей, вплоть до мономолекулярных слоев, сплошной пленки псевдоморфного окисла.
Псевдоморфный окисел обладает высокой степенью ориентационного соответствия металлу и является, таким образом, своеобразным кристаллографическим продолжением решетки окисляемого металла, отличаясь в то же время по параметрам от решетки окисла металла.
Таким образом, даже в случае образования на металле толстой и рыхлой окисной пленки, скорость коррозии в конечном итоге будет лимитироваться не скоростью реакций окисления, а скоростью диффузии кислорода сквозь компактный псевдоморфный окисел.
Если в процессе коррозии образуется окисел, обладающий достаточно хорошими защитными свойствами, то скорость коррозии будет зависеть от соотношения скоростей взаимной диффузии сквозь пленку атомов кислорода к поверхности металла и атомов металла к поверхности раздела фаз «окисел-газ».
Можно показать, что в этом случае по мере роста толщины пленки скорость коррозии будет замедляться по уравнению
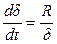 .
.
После интегрирования и преобразований получим параболическую зависимость толщины окисной пленки от продолжительности коррозии
d2 = К×t + А. (5.5)
Такая зависимость наблюдается при окислении цветных металлов (меди, никеля и др.).
В некоторых условиях торможение скорости окисления металла с ростом толщины окисной пленки происходит более интенсивно, чем этого требует параболический закон. В этих случаях скорость окисления связана с толщиной пленки экспоненциальной зависимостью
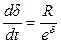 . (5.6)
. (5.6)
После интегрирования приходим к логарифмическому уравнению
d = lg(Kt). (5.7)
Логарифмический закон роста пленки имеет экспериментальное подтверждение при окислении на воздухе таких металлов, как алюминий, цинк, медь, железо. Следует отметить, что закономерности роста пленки на металле могут меняться в зависимости от условий. Так, окисление железа при температуре ниже 658 К подчиняется логарифмическому закону, в области 658…1273 К – параболическому, а при давлении ниже 1 Па и температуре 973…1223 К - линейному.
На поверхности углеродистой стали в процессе коррозии параллельно протекают две группы реакций: окисление железа до окислов с образованием окалины и реакции обезуглероживания с участием карбида железа (цементита) по следующему уравнению
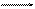 Fe3C + O2 3Fe + CO2.
Fe3C + O2 3Fe + CO2.
В результате этой реакции поверхностный слой металла обедняется цементитом, и при длительном нагреве глубина обезуглероженного слоя может стать значительной (более нескольких миллиметров). Это заметно влияет на твердость и прочность металла. Обезуглероживание наблюдается и при наличии в газовой среде углекислого газа, паров воды или других окислителей и протекает по аналогичным реакциям:

 Fe3C + СO2 3Fe + 2CO; Fe3C + Н2O 3Fe + CO + Н2.
Fe3C + СO2 3Fe + 2CO; Fe3C + Н2O 3Fe + CO + Н2.
Специфично влияет на коррозийную стойкость стали водород, вызывая при повышенной температуре и давлении так называемую водородную хрупкость, т.е. резкое снижение прочности. Водородная хрупкость объясняется не только обезуглероживанием стали за счет восстановления цементита водородом, но и такими явлениями, как молизация атомарного водорода, находящегося в кристаллической решетке стали, и образование по границам зерен металла паров воды и метана. Каждый из процессов приводит к генерированию газа, создающего в замкнутом объеме металла колоссальное давление. Это, в свою очередь, вызывает появление многочисленных микротрещин, понижающих прочность металла.
Разрушение защитной пленки вызывается также резкими температурными изменениями, что связано с различными коэффицентами линейного расширения металла и пленки.
Газовой коррозии подвержены многие цветные металлы, и характер их взаимодействия с окислителем различен.
Кроме кислорода сильными агрессивными свойствами по отношению к металлу обладают и другие газы: фтор, диоксид серы, хлор, сероводород и др.
Их агрессивность по отношению к различным металлам, а следовательно и скорость коррозии, не одинаковы, что объясняется прежде всего свойствами образующихся на поверхности металлов пленок.
Коррозия металлов в неэлектролитах представляет собой разновидность химической коррозии. Органические жидкости, не обладающие электро-проводностью, исключают возможность протекания электрохимических реакций. К ним относятся широко распространенные органические растворители (бензол, толуол и др.), а также жидкие топлива (бензин, керосин, мазут). Диэлектриками являются и некоторые неорганические вещества (расплавленная сера, жидкий фтористый водород и др.). Коррозия в непроводящих средах независимо от их природы сводится к химической реакции между металлом и веществом.
Наиболее практически важной областью коррозии металлов в непроводящих средах является коррозия в среде жидкого топлива – нефти и продуктов ее перегонки. Коррозионно-активными компонентами нефти являются сера, сернистые соединения (сероводород, сероуглерод, тиофены, меркаптаны), кислородсодержащие соединения (карбоновые кислоты, спирты), азотсодержащие соединения и т.д.
Нефть различных месторождений содержит эти соединения в пересчете на серу от 1 % до 5 %. В продуктах перегонки нефти сера распределяется в еще большем интервале.
Чем тяжелее функция перегонки в ряду «бензин-мазут», тем выше содержание серы, поэтому мазут представляет собой более агрессивную среду, чем исходная сырая нефть.
Различные сернистые соединения влияют на металлы неодинаково. Сероводород образует с железом и медью сульфиды, меркаптаны действуют на медь, никель и свинец. При этом образуются производные меркаптанов – меркаптиды. Элементарная сера реагирует с медью, образуя сульфиды. При контакте непредельных углеводородов с металлами их окисление усиливается благодаря каталитическим свойствам металлов.
Повышение температуры увеличивает скорость коррозии металлов в сернистой нефти, фенолах, бензине. В первом приближении эта зависимость может быть описана известным уравнением Аррениуса
lnK = A - 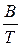 , (5.8)
, (5.8)
где К – скорость реакции;
А, В – константы;
Т – абсолютная температура.
Зависимость (5.8), как правило, совпадает с экспериментальными данными, но в ряде случаев она приобретает более сложный характер, что связано с влиянием вторичных факторов (вторичных реакций), природой и свойствами продуктов коррозии и др.
5.2. Электрохимическая коррозия*
Существуют два подхода к изучению теории электрохимической коррозии.
Первый – теория локальных элементов, объединяющая механизм коррозии работой многочисленных макро- и микрогальванических элементов. Доводы этой теории убедительны, доступны, а качественные оценки закономерностей удобно изучать на моделях гальванических элементов. Получаемые при этом результаты в виде коррозионных диаграмм «потенциал-ток» (диаграммы Эванса) достаточно наглядны. Основной недостаток этой теории – затруднены количественные оценки, так как раздельное распределение суммарных поверхностей катодных и анодных участков весьма сложно, а порой невозможно.
Второй подход – это кинетическая теория. Согласно этой более современной теории в каждом из случаев электрохимической коррозии мы имеем дело с частным проявлением неравновесных электродных процессов, и механизм протекания процессов описывается с позиций закономерностей электрохимической кинетики. Преимущество этой теории – возможность количественной оценки процесса.
Обе теории не должны противопоставляться, они эффективно дополняют друг друга при сохранении ведущего положения за кинетической теорией.
Электрохимическая коррозия металла может проявиться во всех случаях, когда имеет место граница раздела фаз «металл-электролит». Факт появления коррозии не зависит от природы электролита, не имеет существенного значения и его количество – в предельном случае это может быть пленка влаги в несколько десятков миллимикрон. Единственным условием является возможность совмещения на металлической поверхности анодной реакции ионизации металла и катодной реакции восстановления тех или иных ионов, или молекул. Такая возможность реализуется, если равновесный потенциал анодной реакции окажется отрицательнее равновесного потенциала хотя бы одной катодной реакции.
