Составление уравнений реакций ионного обмена
В растворах электролитов направление реакций определяется следующим правилом: ионные реакции протекают в сторону образования малорастворимых веществ, газов, слабых электролитов и комплексных ионов, такие реакции являются практически необратимыми.
Это правило легко объяснимо, т.к. в результате этих реакций один или несколько ионов выводятся из сферы реакции, что, в соответствии с принципом Ла-Шателье, приводит к более полному протеканию химической реакции.
При составлениие ионных реакций обмена, уравнения реакций записывают в 3 строчки:
1) молекулярная форма;
2) полная ионная форма;
3) сокращенно-ионная форма.
В молекулярно-ионных уравнениях растворимые, сильные электролиты пишутся в виде ионов, а слабые электролиты и малорастворимые вещества в виде молекул.
1. Взаимодействие сильных электролитов с образованием осадка:
BaCl2 + H2SO4 = BaSO4 ¯ + 2HCl (молекулярное уравнение)
Ba2++ 2Cl ¯ +2H+ + SO42− = BaSO4 ¯+ 2H+ + 2Cl¯ (полное ионное уравнение)
Ba2+ + SO42− = BaSO4 ¯(сокращенное ионное уравнение)
2. Взаимодействие двух сильных электролитов с образованием слабого электролита:
KCN + HCl = KCl + HCN (молекулярное уравнение)
K+ + CN¯ + H+ + Cl¯ = K+ + Cl¯ + HCN (полное ионное уравнение)
CN¯ + H+ = HCN (сокращенное ионное уравнение)
3. Взаимодействие слабого электролита с сильным:
H2S + Pb(NO3)2 = PbS¯ + 2HNO3 (молекулярное уравнение)
H2S + Pb2+ + 2NO3¯ = PbS¯ + 2H+ + 2NO3¯ (полное ионное уравнение)
H2S + Pb2+ = PbS¯ + 2H+ (сокращенное ионное уравнение)
4. Взаимодействие осадка с кислотой:
ВaCO3¯+ 2HCl = BaCl2 + H2O + CO2(молекулярное уравнение)
BaCO3¯+2H+ + 2Cl¯ = Ba2+ + 2Cl¯ + H2O +CO2 (полное ионное уравнение)
BaCO3¯ + 2H+ = Ba2+ + H2O + CO2 (сокращенное ионное уравнение)
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. Исходя из значений ПР, укажите наиболее растворимый и наименее растворимый в воде гидроксид:
1) Ni(OH)2; 2) Pb(OH)2; 3) Sn(OH)2; 4) Zn(OH)2; 5) Ca(OH)2.
Решение: Выписываем значения ПР для всех оснований:
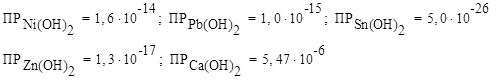
Сравнивая значения, видим, что наибольшее значение ПР у Са(ОН)2, значит данный гидроксид наиболее растворим в воде.
Наименьшее значение ПР у Sn(ОН)2, значит данный гидроксид наименее растворим в воде.
Пример 2. Будет ли образовываться осадок СaSO4, если концентрация ионов кальция в растворе – 0,001 моль/л, концентрация сульфат - ионов – 0,003 моль/л.
Решение:
Дано: 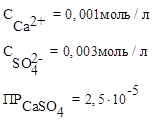 | Условие образования осадка: 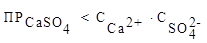 В соответствии с уравнением реакции: Сa2+ + SO42− = CaSO4 c 0,001 моль/л ионами кальция будет реагировать 0,001 моль/л сульфат-ионов: 2,5∙10-5 < 0,001·0,001 2,5∙10-5 < 1·10−6 Осадок будет образовываться. В соответствии с уравнением реакции: Сa2+ + SO42− = CaSO4 c 0,001 моль/л ионами кальция будет реагировать 0,001 моль/л сульфат-ионов: 2,5∙10-5 < 0,001·0,001 2,5∙10-5 < 1·10−6 Осадок будет образовываться. |
Пример 3. Для данных соединений: CoS, CaF2, Ag2S, Ca3(PO4)2 напишите выражение произведения растворимости.
Решение: В насыщенном растворе малорастворимого соединения произведение концентрации его ионов в степени их стехиометрических коэффициентов есть величина постоянная, называемая произведением растворимости – ПР. Составим уравнения диссоциации солей:
СоS ⇄ Co2+ + S2− => 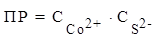
CaF2 ⇄ Ca2+ + 2F¯ => 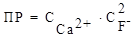
Ag2S ⇄ 2Ag+ + S2− => 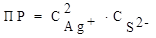
Ca3(P4)2 ⇄ 3Ca2+ + 2PO43− => 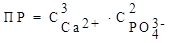
Пример 4. Какая из предложенных реакций обмена идет до конца ?
1) Na2CO3 + 2KCl = 2NaCl + K2CO3
2) MgCO3 + 2HNO3 = Mg(NO3)2 + H2CO3
3) K2CO3 + 2NaOH = 2KOH + Na2CO3
4) Li2CO3 + 2KOH = 2LiOH + K2CO3
5) Na2CO3 + K2SO4 = Na2SO4 + K2CO3
Решение: Реакция протекает необратимо (т.е. до конца), при условии:
- выпадения вещества в осадок,
- образования слабого электролита (слабой кислоты H2S, H2CO3 и т.д., слабого основания - NH4OH или воды),
- неэлектролита (газа - CO2, SO2 и т.д.)
В продуктах реакции находим нерастворимую соль или основание, воду или слабые электролиты. В данном случае это угольная кислота – H2CO3. Составляем полное ионное и сокращенное ионное уравнения (карбонат магния не растворим в воде):
MgCO3 + 2H+ +2NO3¯ = Mg2+ + 2NO3¯ + СO2 + H2O
MgCO3 + 2H+ = Mg2+ + CO2↑ + H2O
Пример 5. Какое из молекулярных уравнений реакции можно выразить следующим сокращенным ионным уравнением:
Ca2+ + CO32−→ CaCO3 ?
1) Ca3(PO4)2 + 3Na2CO3 = 3CaCO3 + 2Na3PO4
2) Ca3(PO4)2 + 3PbCO3 = 3CaCO3 + Pb3(PO4)2
3) CaSO4 + ZnCO3 = CaCO3 + ZnSO4
4) CaCl2 + CuCO3 = CaCO3 + CuCl2
5) CaCl2 + Na2CO3 = CaCO3 + 2NaCl
Решение: Для получения в растворе ионов Ca2+, необходимо подобрать в исходных веществах растворимую соль кальция. Фосфат и сульфат кальция нерастворимы в воде, поэтому выбираем хлорид кальция. Т.е. варианты ответов № 1,2,3 уже не верные. Для получения в растворе ионов CO32- необходимо подобрать в исходных веществах растворимую соль содержащую карбонат-ионы. Т.к. карбонат меди не растворим, то выбираем карбонат натрия. Правильным ответом является вариант № 5.
Пример 6. Рассчитайте рН 0,1 моль/л раствора NaOH.
Решение: Концентрация ионов OH- в растворе, в соответствии с уравнением диссоциации гидроксида натрия, равна 0,1моль/л:
NaOH → Na+ + OH¯
В соответствии с уравнением:
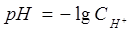 , концентрация ионов водорода нам не известна.
, концентрация ионов водорода нам не известна.
Из ионного произведения воды найдем концентрацию ионов водорода:
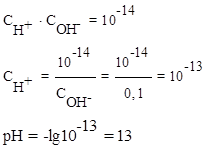
Пример 7. Напишите уравнения диссоциации ортофосфорной кислоты по ступеням и константы диссоциации по каждой ступени.
Решение:
1 ступень диссоциации: H3PO4 ⇄ H+ + H2PO4¯
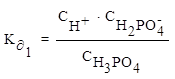
2 ступень диссоциации: H2PO4¯⇄ H+ + HPO42−
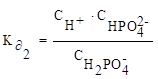
3 ступень диссоциации: HPO42−⇄ H+ + PO43−
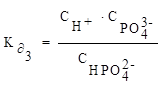
Пример 8. Напишите уравнения диссоциации гидроксида меди по ступеням и константы диссоциации по каждой ступени.
Решение:
1 ступень диссоциации: Cu(OH)2 ⇄ CuOH+ + OH¯
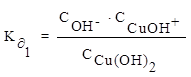
2 ступень диссоциации: CuOH+ ⇄ Cu2+ + OH¯
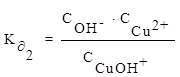
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Написать уравнения ступенчатой диссоциации и выражения констант диссоциации по каждой ступени для ортофосфорной кислоты, гидроксида цинка.
2. Для данных солей CuS, NiS, ZnS, PbS, FeS выписать значения ПР и выбрать наиболее растворимую и наиболее нерастворимую соль.
3. Для данных соединений– PbI2, CaCO3, Ag2SO4 написать выражение произведения растворимости.
4. Концентрация раствора HCl равна 0,01 моль/л, вычислить рН раствора и концентрацию ионов ОН¯.
5. Какие из реакций протекают до конца, для них напишите уравнения реакций в молекулярном и ионном виде:
- хлорид кобальта(II) и гидроксид калия
- хлорид меди(II) и сероводородная кислота
- серная кислота и гидроксид натрия
- сульфат натрия и хлорид никеля(II)
- гидроксид цинка и гидроксид натрия
6. Для данного сокращенно – ионного уравнения подберите 4 молекулярные реакци Zn2+ + S2−= ZnS¯
4 ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование:штативы, пробирки, набор реактивов в капельницах и бюксах.
Опыт 1. Ионные реакции обмена с образованием осадков.
а) Налейте в три пробирки по 5-6 капель фосфата натрия и добавьте в первую пробирку - 5-6 капель нитрата кобальта, во вторую - 5-6 капель сульфата никеля, в третью пробирку - 5-6 капель сульфата меди. Составьте уравнения реакций в молекулярном и ионном виде.
б) Исходя из ионного уравнения, составьте молекулярное уравнение и проведите опыт:
Pb2+ + 2I¯ = PbI2¯
Ba2+ + Cr2O72- =BaCr2O7¯
Опыт 2. Ионные реакции обмена с образованием слабого электролита.
а) Положите в пробирку несколько кристаллов ацетата натрия и добавьте разбавленную серную кислоту. Напишите уравнения реакции в молекулярном и ионном виде.
б) Налейте в пробирку несколько капель хлорида аммония и добавьте гидроксид калия, определите выделяющийся газ по запаху (при отсутствии запаха пробирку можно слегка подогреть). Напишите уравнение реакции в молекулярном и ионном виде.
в) Внесите в 2 пробирки по 1 шпателю карбоната кальция и добавьте в первую немного дистиллированной воды, во вторую 5-6 капель соляной кислоты. В какой пробирке происходит растворение осадка? Напишите уравнение реакции в молекулярном и ионном виде.
Опыт 3. Смещение ионного равновесия.
а) Налейте в две пробирки по 6-8 капель гидроксида аммония, добавьте 2 капли фенолфталеина. Затем в одну из пробирок добавьте 1 шпатель хлорида аммония, отметьте изменение интенсивности окраски. Объясните, как смещается равновесие в растворе при добавлении хлорида аммония.
б) Налейте в две пробирки по 6-8 капель уксусной кислоты, добавьте 2 капли метилового оранжевого, в одну из пробирок добавьте 1 шпатель ацетата натрия. Сравните интенсивность окраски в пробирках. Отметьте, как смещается равновесие в растворе при добавлении соли.
Опыт 4. Выпадение осадков малорастворимых веществ в зависимости от их произведения растворимости.
Внесите в две пробирки 5-6 капель сульфата натрия, в первую добавьте 5-6 капель хлорида кальция. Во вторую 5-6 капель хлорида бария. Объясните образование осадков, на основании ПР, образующихся солей. Напишите уравнение реакции в молекулярном и ионном виде.
Лабораторная работа № 6
ГИДРОЛИЗ СОЛЕЙ
Цель работы:составление уравнений гидролиза одной соли, совместного гидролиза двух солей, определение рН раствора. Смещение равновесия при гидролизе солей
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Гидролизом солейназываются обменные химические реакции ионов солей с водой, сопровождающиеся, как правило, изменением рН среды.
Гидролиз солей может протекать тогда, когда в результате взаимодействия ионов соли и воды образуются малодиссоциированные вещества. Сущность гидролиза состоит в том, что катион соли (слабое основание) либо её анион (слабая кислота) связывают соответственно ионы OH¯ или H+ с образованием слабого электролита (соответственно основания или кислоты).
Гидролизу подвергаются соли образованные:
1. слабым основанием и сильной кислотой (гидролиз по катиону),
2. сильным основанием и слабой кислотой (гидролиз по аниону),
3. слабым основанием и слабой кислотой.
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.
Уравнения реакций гидролиза пишутся аналогично ионным уравнениям: слабые электролиты (в том числе и вода), малорастворимые вещества и газообразные продукты гидролиза пишутся в виде молекул, сильные электролиты записываются в виде ионов. Реакции солей, образованные многоосновными кислотами и многокислотными основаниями пишутся по ступеням, в соответствии с их ступенчатой диссоциацией. Следует помнить, что гидролиз соли по второй и третьей ступени протекает в очень незначительной степени.
Уравнения гидролиза
1) Гидролиз соли, образованной сильным основанием и слабой кислотой.
KCN + H2O ⇄ HCN + KOH молекулярное уравнение
K+ + CN¯ + H2O ⇄ HCN + K+ + OH¯ полное ионно-молекулярное уравнение
CN¯ + H2O ⇄HCN + OH¯ сокращенное ионно-молекулярное уравнение
Ступенчатый гидролиз:
I ступень:
K2CO3 + H2O ⇄ KHCO3 + KOH
2K+ + CO32¾ + H2O ⇄ K+ + HCO3¯ + K+ + OH¯
CO32¾ + H2O ⇄ HCO3¯ + OH¯
II ступень:
KHCO3 + H2O ⇄ H2CO3 + KOH
K+ + HCO3¯ + H2O ⇄ H2CO3 + K+ + OH¯
HCO3¯ + H2O ⇄ H2CO3 + OH¯
Соль сильного основания и слабой кислоты гидролизуется с увеличением концентрации гидроксид-ионов в растворе, при этом рН раствора становится больше 7.
2) Гидролиз соли, образованной слабым основанием и сильной кислотой.
NH4Cl + H2O ⇄ NH4OH + HCl молекулярное уравнение
NH4+ + Cl¯ + H2O ⇄ NH4OH + H+ + Cl¯ полное ионно-молекулярное уравнение
NH4+ + H2O ⇄ NH4OH + H+ сокращенное ионно-молекулярное уравнение
Ступенчатый гидролиз:
I ступень:
CuCl2 + H2O ⇄ CuOHCl + HCl
Cu2+ + 2Cl¯ + H2O ⇄ CuOH+ + Cl¯ + H+ + Cl¯
Cu2+ + H2O ⇄ CuOH+ + H+
II ступень:
CuOHCl + H2O ⇄ Cu(OH)2 + HCl
CuOH+ + Cl¯ + H2O ⇄ Cu(OH)2 + H+ + Cl¯
CuOH+ + H2O ⇄ Cu(OH)2 + H+
Соль слабого основания и сильной кислоты гидролизуется с увеличением концентрации ионов водорода в растворе, при этом рН раствора становится меньше 7.
3) Гидролиз соли, образованной слабым основанием и слабой кислотой.
NH4CN + H2O ⇄ HCN + NH4OH
В реакции гидролиза участвуют и катион, и анион соли, связывающие соответственно гидроксид-ионы и ионы водорода. Гидролиз протекает практически до конца. Поэтому реакция среды в результате гидролиза определяется относительной силой образующейся слабой кислоты и слабого основания, и часто бывает нейтральной. Для определения реакции среды в данном случае следует сравнить константы диссоциации полученной кислоты и основания. Так, для приведенного примера: Кд (NH4OH) = 1,8×10-5, Kд (HCN) = 7,1×10-10, циановодородная кислота является более слабым электролитом, поэтому реакция среды будет щелочной.
Если рассмотреть гидролиз ацетата аммония:
CH3COONH4 + H2O ⇄CH3COOH + NH4OH
то реакция среды будет нейтральная, т.к. Кд(CH3COOH)=1,8×10-5
Kд(NH4OH) = 1,8×10-5.
4) Гидролиз соли, образованной сильным основанием и сильной кислотой.
Гидролиз соли образованной сильным основанием и сильной кислотой не протекает.
5) Совместный гидролиз двух солей
Гидролиз некоторых солей, образованных очень слабыми кислотами и основаниями является необратимым, например гидролиз сульфидов и карбонатов Al3+, Cr3+, Fe3+.
Al2S3 + 6H2O = 2Al(OH)3 +3H2S
Эти соединения нельзя получить в водном растворе (в таблице растворимости стоит прочерк). При взаимодействии солей этих металлов с растворами сульфидов и карбонатов в осадок выпадают не сульфиды и карбонаты, а гидроксиды алюминия, хрома (III), железа (III).
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3¯ + 3H2S + 6NaCl
2Al3+ + 6Cl¯ + 6Na+ + 3S2¾ + 6H2O = 2Al(OH)3 ¯+ 3H2S + 6Na+ + 6Cl¯
2Al3+ + 3S2¾ + 6H2O = 2Al(OH)3¯ + 3H2S
Константа гидролиза
С количественной точки зрения гидролиз можно охарактеризовать константой гидролиза.
1) Гидролиз соли образованной сильным основанием и слабой кислотой:
CH3COO¯ + H2O ⇄ CH3COOH + OH¯
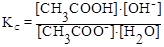
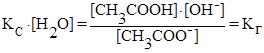 (константа гидролиза)
(константа гидролиза)
но [OH¯] = Kw/[H+] (из ионного произведения воды), тогда
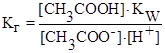
выражение 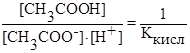
где Ккисл – константа диссоциации слабой кислоты
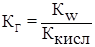
Аналогично для других случаев получим:
2) Гидролиз соли образованной слабым основанием и сильной кислотой
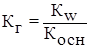 (Косн – константа диссоциации слабого основания)
(Косн – константа диссоциации слабого основания)
3) Гидролиз соли образованной слабым основанием и слабой кислотой
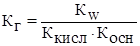
В соответствии с принципом Ла-Шателье гидролитическое равновесие может смещаться под влиянием различных факторов. Разбавление раствора соли может рассматриваться как увеличение концентрации воды, что приводит к усилению гидролиза.
Повышение температуры влияет на гидролиз главным образом вследствие резкой температурной зависимости степени диссоциации воды. Поэтому при нагревании увеличивается диссоциация воды и следовательно вероятность связывания ионов водорода и гидроксид-ионов в малодиссоциирующее соединение. Гидролиз усиливается.
Чтобы уменьшить гидролиз следует добавить кислоту или основание в зависимости от того, какой гидролиз протекает — по катиону или аниону.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оборудование:штативы, пробирки, спиртовки, держатели, набор реактивов в капельницах и бюксах.
Опыт 1. Определение реакции среды в растворах солей
В первую пробирку внесите 5-6 капель соляной кислоты, во вторую пробирку внесите 5-6 капель воды, в третью пробирку внесите 5-6 гидроксида калия. Во все пробирки добавьте по 1-2 капли тимолового синего. Заполните таблицу 6.1.
Таблица 6.1
Окраска индикатора в зависимости от среды
| Вещество | Среда | рН | Окраска индикатора |
| HCl | |||
| H2O | |||
| KOH |
Внесите в пробирки по 1/2 шпателя солей, указанных в таблице, добавьте к ним 1 мл воды. Внесите во все пробирки 1-2 капли индикатора тимолового синего. По окраске индикатора определите реакцию среды, значение рН определите как, рН>7, pH<7, pH=7. Также значения рН можно определить по окраске универсального индикатора и рН-метром. Заполните таблицу 6.2.
Напишите уравнения гидролиза для каждой соли в молекулярном и ионно-молекулярном виде, укажите тип гидролиза.
Таблица 6.2
Реакция среды в растворах солей
| Формула соли | Окраска индикатора | Реакция среды | рН |
| SnCl2 Li2CO3 NaCl AlCl3 KNO2 Pb(CH3COO)2 |
Опыт 2. Совместный гидролиз двух солей
Налейте в пробирки по 5-6 капель хлорида алюминия и хлорида хрома, добавьте в пробирки несколько капель карбоната натрия, до выпадения осадка.Напишите уравнения совместного гидролиза в молекулярном и ионно-молекулярном виде.
Опыт 3. Влияние температуры на степень гидролиза
К раствору ацетата натрия добавьте 1 каплю фенолфталеина, отметьте окраску раствора. Нагрейте пробирку с раствором до кипения, как изменится интенсивность окраски? Объясните полученный результат. Пробирку охладите в холодной воде. Что происходит?
Опыт 4. Смещение равновесия реакции гидролиза соли при разбавлении раствора
Налейте в колбу 50 мл дистиллированной воды и внесите 1-2 капли раствора сульфата меди. Через некоторое время наблюдайте появление осадка. Объясните, почему при разбавлении раствора усиливается гидролиз.
Лабораторная работа № 7
