Равновесие в растворах электролитов
Электролиты – химические вещества и системы, в которых прохождение электрического тока осуществляется за счет движения ионов. Такие проводники относятся к проводникам второго рода. Наличие свободных ионов объясняется явлением диссоциации (ионизации) – распадом молекул на ионы: а) при образовании растворов - под действием полярных молекул растворителя (электролитическая диссоциация); б) при образовании расплавов - в результате термического распада (термическая диссоциация). В зависимости от степени электролитической диссоциации a = n/N, (где n – число распавшихся молекул, N-исходное число растворенных молекул) электролиты подразделяются на сильные (a »1), слабые (a < 0,03) и средней силы (0,03 < a < 0,3). Степень диссоциации зависит от концентрации электролита (чем больше концентрация – тем меньше степень диссоциации).
Обратимый процесс диссоциации слабых электролитов характеризуется константой диссоциации Кд. Например, для слабой уксусной кислоты, процесс диссоциации которой идет в соответствии с уравнением CH3COOH « H+ + CH3COO -,
Кд = 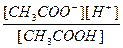
В зависимости от величины Кд электролиты подразделяются на сильные (Кд >10-3) и слабые (Кд< 10 -3). Кд зависит только от природы электролита и температуры и является табличной величиной.
Для слабых электролитов бинарного типа (распадаются на один катион и один анион) взаимосвязь между исходной концентрацией растворенного вещества (молярностью раствора -См), степенью и константой диссоциации выражается законом разведения Оствальда: Кд = a2См
Реакции ионного обмена
Для растворов электролитов наиболее характерны реакции ионного обмена. Обязательным условием протекания таких реакций практически до конца является удаление из раствора тех или иных ионов в следствие:
1) образования осадка
FeSO4 + 2 NaOH ® Fe(OH )2¯ + Na2SO4 - молекулярное уравнение (МУ)
Fe2++SO42-+2Na++2OH-®Fe(OH)2¯+2Na++SO42— ионно-молекулярное уравнение (ИМУ).
Fe2+ +2OH- ® Fe(OH)2¯ ПР (Fе(OH)2) = 4,8×10-16 – краткое ионно-молекулярное уравнение образования осадка;
Выделение газа
Na2CO3 + 2H2SO4 ® H2CO3 + 2NaHSO4 (МУ)
2Na+ +CO32- + 2H+ + 2HSO4- ® H2CО3 + 2Na+ + 2HSO4- (ИМУ)
2H+ + CO32- ® H2C03
Угольная кислота является нестойкой, поэтому она разлагается:
H2CO3 ® H2О +CО2
2H+ + CO32- ® H2O + CО2 - ионно-молекулярное уравнение образования летучего соединения и слабого электролита Н2О.
3) образование мало диссоциирующих веществ
а) 2KCN + H2SO4 ®2HCN + K2SO4 (МУ);
2K+ + 2CN- + 2H+ +SO42- ® 2HCN + 2K+ +SO42- (ИМУ);
CN- + H+ ® HCN –ионно-молекулярное уравнение образования слабого электролита HCN (КдHCN)= 7,8´10-10).
б) NaOH + HCl ® NaCl + H2O (МУ)
Na+ + OH- + H+ + Cl- ® Na+ + Cl- + H2O (ИМУ)
OH- + H+ ® H2O ионно-молекулярное уравнение образования слабого электролита H2O (КдH2O = 1,8´10-16)
4) образование комплексных соединений
ZnCl2 + 4NH3 ® [Zn (NH3)4]Cl2 (МУ);
Zn2+ + 2Cl- +4NH3 ® [ Zn (NH3)4]2+ + 2Cl- -(ИМУ);
Zn2++4NH3 ® [Zn(NH3)4]2+-ионно-молекулярное уравнение образования комплексного катиона.
Встречаются процессы, при которых слабые электролиты или малорастворимые соединения входят в число исходных веществ и продуктов реакции. Равновесие в этом случае смещается в сторону образования веществ, имеющих наименьшую константу диссоциации или в сторону образования менее растворимого вещества:
NH4OH + HCl ® NH4Cl + H2O (МУ);
NH4OH + H+ + Cl- ® NH4+ + Cl- + H2O (ИМУ);
NH4OH + H+ ® NH4+ + + H2O (ИМУ);
Кд(NH4OH) =1,8× 10-5 Кд(H2O) =1,8×10-16
Равновесие сдвинуто в сторону образования молекул воды, т.е реакция протекает в прямом направлении.
HCN + CH3COONa ® NaCN + CH3COOH (МУ);
HCN + CH3COO- + Na+ ® Na+ + CN- + CH3COOH (ИМУ);
HCN + CH3COO- ® CN- + CH3COOH
Kд(HCN)=7,9× 10-10 Кд(CH3COOH) =1,8 ×10-5
Равновесие сдвинуто в сторону образования HCN, т.е. реакция практически не протекает
AgCl + NaI ®AgI + NaCl (МУ);
AgCl + Na+ +I- ®AgI + Na+ +Cl- (ИМУ);
AgCl + I- ®AgI + Cl-
ПР(AgCl)=1,78×10-10, ПР(AgI) =8,3×10-17
Равновесие сдвинуто в сторону образования труднорастворимого соединения AgI.
Могут встречаться процессы, в уравнениях которых есть и малорастворимое соединение и слабый электролит
MnS + 2HCl ® MnCl2 + H2S
MnS + 2H+ +2Cl- ® Mn 2+ + 2Cl- + H2S
MnS¯ + 2 H+ ®Mn2+ + H2S
ПР(MnS)=2,5×10-10; [S-2]= 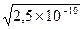 =1,58.10-5 моль/л
=1,58.10-5 моль/л
Kд (H2S)= K1×K2= 6´10-8´1´10-14 =6×10-22; [S2-]= 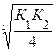 =0,54.10-7.
=0,54.10-7.
Связывание ионов S2- в молекулы H2S происходит полнее, чем в MnS, поэтому реакция протекает в прямом направлении.
Задачи
77.Будут ли протекать реакции между растворами следующих электролитов:
1) K2CO3 и HCl; 2) KNO3 и Na2S; 3) CdSO4 и NaOH? Написать молекулярные и ионно-молекулярные уравнения возможных реакций.
78. С помощью молекулярных и ионно-молекулярных уравнений ответить на вопрос: при смешении растворов каких солей можно получить в осадке карбонат кальция?
79. Будут ли протекать реакции между растворами следующих электролитов: Ba(OH)2 и HNO3; 2) (NH4)2SO4 и KOH; 3) CuSO4 и NaOH? Написать молекулярные и ионно-молекулярные уравнения возможных реакций.
80.С помощью молекулярных и ионно-молекулярных уравнений ответить на вопрос: растворы каких солей надо смешать для получения в осадке сульфата бария?
81. Написать молекулярные и ионно-молекулярные уравнения реакций между растворами следующих электролитов:
1) сульфита натрия и серной кислоты; 2) хлорида цинка и гидроксида натрия; 3) карбоната калия и соляной кислоты.
82. Написать молекулярные и ионно-молекулярные уравнения реакций: 1) растворения сульфида железа (II) в соляной кислоте; 2) взаимодействия сульфата кадмия и гидроксида натрия; 3) растворения гидроксида алюминия в избытке раствора щелочи.
83. Можно ли приготовить раствор, содержащий одновременно следующие пары веществ: 1) CuSO4 и NaNO3; 2) Na2CO3 и HCl; 3) AgNO3 и NaCl? Ответ обосновать с помощью молекулярных и ионно-молекулярных уравнений.
84. Смешивают попарно растворы: 1) NaOH и HNO3; 2) K2CO3 и HCl; 3) CuSO4 и KOH. В каких случаях протекают реакции? Составить их молекулярные и ионно-молекулярные уравнения.
85. Написать уравнения реакций между растворами следующих электролитов: 1) К2CO3 и НСl; 2) AgNO3 и K2CrO4; 3) Zn(OH)2 и KOH(избыток).
86. Будут ли протекать реакции между растворами следующих электролитов: Na2SO4 и BaCl2; 2) NaHCO3 и NaOH; 3) Pb(NO3)2 и KOH? Написать молекулярные и ионно-молекулярные уравнения возможных реакций.
87. Смешивают попарно растворы следующих электролитов: 1) NaOH и HCl; 2) K2SО3 и HCl; 3) H2SO4 и CH3COONa. Какие из реакций протекают практически до конца? Составить молекулярные и ионно-молекулярные уравнения соответствующих реакций.
88. Составить молекулярные и ионно-молекулярные уравнения реакций, происходящих в растворах между: 1) сероводородом и сульфатом никеля (II); 2) гидрокарбонатом и гидроксидом калия; 3) хлоридом аммония и гидроксидом калия.
89. Написать молекулярные и ионно-молекулярные уравнения реакций нейтрализации:
1) HCl + Ba(OH)2; 2) Fe(OH)2 + HNO3; 3) H2S + NaOH. Указать какие из этих реакций протекают обратимо.
90. Написать молекулярные и ионно-молекулярные уравнения реакций, протекающих в растворах между: 1) Na2SO3 и HCl; 2) Cr2(SO4)3 и KOH; 3) Na2CrO4 и AgNO3. Указать в каждом случае соединение, образование которого вызывает смещение равновесия.
91. Составить молекулярные уравнения к следующим ионно-молекулярным уравнениям:
| 1) Fe(OH)2 + 2H+= Fe2+ + 2 H2O; | 2) H+ + OH- + H2O; |
| 3) 2 Ag+ + SO42- = Ag2SO4; | 4) Fe3+ + 3OH- = Fe(OH)3; |
| 5) NH4+ + OH- = NH4OH; | 6) 2H+ + CO32- = H2O + CO2; |
| 7) Sn2+ + 2 OH- = Sn(OH)2; | 8) Zn(OH)2+2OH- = [Zn(OH)4]2- |
| 9) Ca2+ + CO32- = CaCO3; | 10) ZnS + 2 H+ = H2S + Zn2+; |
| 11) H+ + NO2- = HNO2; | 12) Sn(OH)2+2OH- = [Sn(OH)4] 2- |
| 13) Cd2+ + 2 OH- = Cd(OH)2; | 14) CuS + 2 H+ = H2S + Cu2+; |
| 15) Ag+ + Cl- = AgCl; | 16) 2H+ + S2- = H2S; |
| 17) HCO3- + H+ = H2CO3; | 18) 2Ag+ + CrO42- = Ag2CrO4; |
| 19) CaCO3 +2 H+ = Ca2+ + CO2 + H2O; | 20) CH3COO- + H+ = CH3COOH; |
| 21) Cu(OH)2 +2H+ = Cu2+ + H2O; | 22) Ni2+ + S2- = NiS; |
| 23) SO32- + 2 H+ = SO2+ H2O; | 24) Mg2+ + 2OH- = Mg(OH)2; |
| 25) Ba2+ + SO42- = BaSO4; | 26) HNO2 + OH- = NO2- + H2O; |
| 27) Pb2+ + 2 Cl- = PbCl2; | 28) Al3+ + 3 OH-= Al(OH)3; |
| 29) Al(OH)3 + OH- = [Al(OH)4]-; | 30) 2 H+ + Zn(OH)2 = Zn2+ + 2H2O. |
