Электролиз растворов электролитов
В водных растворах процесс электролиза усложняется, т.к. в нем могут принимать участие молекулы воды (на катоде возможно восстановление иона Н+, а на аноде – окисление ОН- из молекулы воды).
При решении вопроса, какой из ионов будет в первую очередь разряжаться на электроде, руководствуются принципом наименьшей энергии: из всех возможных процессов протекает тот, на который тратится наименьшее количество энергии. В аспекте электрохимических процессов этот принцип заключается в следующем: на катоде восстанавливаются те окислители, которые имеют наибольшее значение потенциала, на аноде окисляются те восстановители, которые имеют наименьшее значение потенциала.
Т.о., на аноде выбираем процесс с меньшим потенциалом. Необходимо также учесть материал анода – инертный анод или растворимый (см. табл. 3).
На катоде первую очередь будут разряжаться ионы с бóльшим потенциалом.
Это общие принципы. В реальности часто протекают конкурирующие процессы ввиду близости потенциалов различных ионов, и процесс электролиза довольно сложен. Для написания уравнений реакций необходимо руководствоваться некоторыми правилами, собранными в таблице 3 и таблицей электродных потенциалов (см. приложение).
Таблица 3. Последовательность разряда ионов при электролизе растворов
| Анод | Катод |
| 1) Если растворимый анод, то он окисляется: Cu – 2e– → Cu2+ 2) Если есть анионы галогенов (Cl-, Br-, I-), то они окисляются: 2Cl– – 2e– → Cl2 3) О-содержащие анионы с максимальной с.о. неметалла не разряжаются, окисляются молекулы воды: 2H2O – 4e– → O2 + 4H+ | 1) Ионы металлов, выше Al не разряжаются, восстанавливаются молекулы воды; 2H2О + 2e– → H2 + 2ОН- 2) Ионы металлов ниже Н+ разряжаются: Cu2+ + 2e– → Cu 3) Ионы металлов между Al и H+: разряжается и металл, и Н2О |
Рассмотрим примеры электролиза растворов некоторых солей.
Пример 1. Электролиз раствора хлорида натрия с угольными электродами.
На первом этапе записываем диссоциацию соли и ионы (или молекулы), способные разрядиться на электродах:
NaCl → Na+ + Cl-
К(-) Na+
Н2О
А(+) Cl-
Н2О
На втором этапе нужно осуществить выбор процесса в соответствии с табл. 3.
На катоде осуществляем выбор между ионом натрия и молекулой воды. В соответствии с табл. 3, выбираем молекулы воды, т.к. ион натрия в таблице электродных потенциалов стоит выше алюминия. (К аналогичному выводу придем, если сравним потенциалы натрия -2,71 В и воды при рН 7 -0,414 В. Выбираем бóльший потенциал, т.е. воду).
Таким образом можем записать процесс, протекающий на катоде:
К(-) Na+
2H2О + 2e– → H2 + 2ОН-
На аноде выбираем между ионом хлора и молекулой воды. В соответствии с таблицей 3, если в растворе присутствуют ионы галогенов, то они разряжаются. Поэтому анодный процесс:
А(+) 2Cl– – 2e– → Cl2
Н2О
Суммарное уравнение электролиза:
2NaCl + 2H2O → Cl2 + H2 + 2NaOH
Пример 2. Электролиз раствора сульфата меди с угольными электродами.
На катоде разряжается медь (бóльший потенциал).
К(-) Cu2+ + 2e- → Cu
Н2О
На аноде – молекулы воды, сульфат-ионы не окисляются
А(+) SO42-
2H2O – 4e– → O2 + 4H+
Суммарное уравнение электролиза:
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Законы Фарадея
Явление электролиза было открыто Майклом Фарадеем в 1833 г. Сформулированные им законы, описывающие процесс электролиза, можно объединить в единый закон:
Масса вещества, выделившегося на электроде в процессе электролиза, пропорциональна количеству электричества, прошедшего через электролизер.
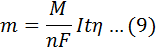
где m – масса вещества, выделившегося на электроде, (г);
М – молярная масса вещества;
n – количество электронов, участвующих в полуреакции на электроде; (величину М/n также называют электрохимическим эквивалентом и обозначают Э)
I – сила тока (А);
F – постоянная Фарадея, 96500 Кл/моль;
t – время (с);
h – выход по току.
Применение электролиза
Электролиз широко применяется в современной промышленности. Перечислим основные области применения электролиза.
1) Получение различных веществ в химической промышленности. Электролизом получают галогены (хлор, бром), щелочи, водород, кислород, хлораты и т.д.
2) Извлечение металлов из руд и их очистка в металлургии. Электролизом расплавов получают ряд металлов – алюминий, магний, бериллий. Очистка металлов с помощью электролиза – рафинирование. Из неочищенного металла отливают электрод и используют его в качестве анода. Материал анода окисляется, ионы металла переходят в раствор, а затем восстанавливаются на катоде.
3) Гальванотехника – нанесение металлических покрытий с помощью электролиза. Различают гальваностегию и гальванопластику. Гальваностегия – нанесение тонких металлических покрытий на поверхность другого металла (он является катодом при электролизе). Таким образом проводят цинкование, никелирование, меднение, хромирование, серебрение, золочение и т.д. Используется для повышения коррозионной стойкости и изностойкости, для декоративной отделки изделий.
Гальванопластика – получение копий значительной толщины с различных металлических или неметаллических матриц. Этим способом делают копии с произведений искусства, различные объемные детали, трубы.
4) Электрохимическое травление и полирование, основанные на анодном растворении металла.
5) Получение оксидных защитных пленок на поверхности металла – анодирование.
6) Очистка сточных вод – электрокоагуляция, электрофлотация.
Коррозия металлов
Коррозией называется самопроизвольный процесс разрушения металлов в результате их взаимодействия с окислителями из окружающей среды. Выплавка металлов из руд требует затраты энергии. При коррозии происходит самопроизвольное высвобождение из металлов накопленной свободной энергии Гиббса. Это делает металлы химически активными веществами:
Меn+ + ne- → Me (∆G > 0) Me0 – ne- → Меn+ (∆G < 0)
металлургия коррозия
При коррозии происходит медленное выделение тепловой энергии и рассеивание продуктов коррозии в окружающую среду. В связи с этим, с точки зрения термодинамики, процесс коррозии сопровождается уменьшением энтальпии (∆Н < 0) и приращением энтропии (∆S > 0). Согласно второму закону термодинамики такие процессы необратимы и протекают самопроизвольно до момента достижения равновесия в системе. В данном случае равновесие в коррозионных процессах невозможно из-за не прекращаемого поступления окислителя к поверхности металла. Следовательно, коррозия металлов есть необратимый процесс и приводит к большим прямым и косвенным потерям.
Безвозвратные потери металла ежегодно составляют около 15% от выпуска, а с учетом косвенных потерь (остановка работы железнодорожных узлов из-за корродированных контактов опорных систем, потеря нефтепродуктов или выброс природного газа и других пожароопасных веществ через коррозионные отверстия в цистернах и т.д.) исчисляются миллиардами рублей ежегодно.
Следует отметить, что коррозии не подвержены такие металлы, как золото, серебро, платина, ртуть, так как эти металлы в природе находятся в свободном состоянии и не требуют энергетических затрат на их получение.
Коррозионный процесс характеризуют по виду разрушения поверхности металла и механизму его протекания (типу).
На рис. 3 показаны различные виды коррозионных разрушений металлов:
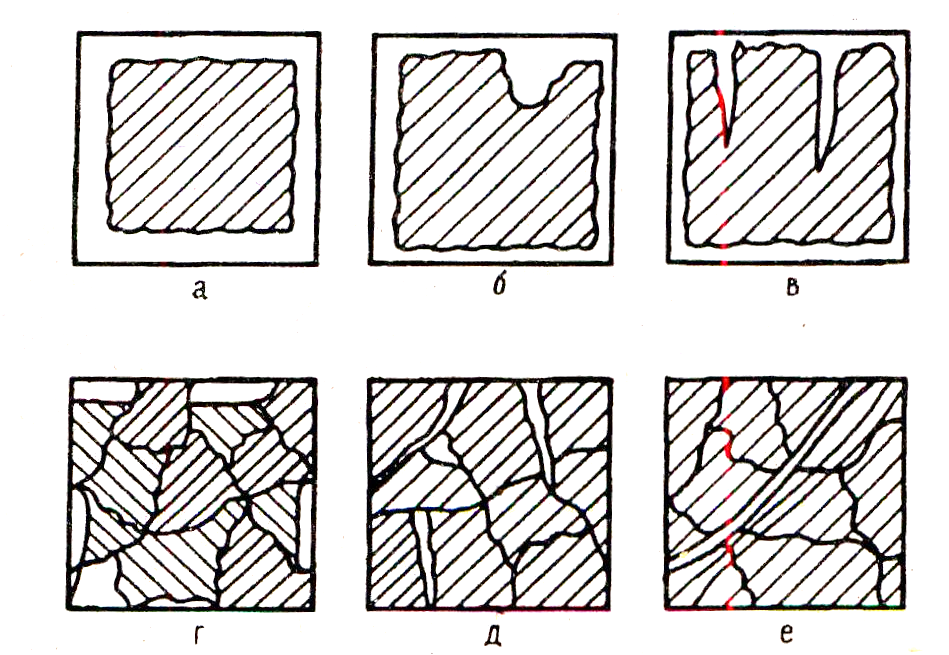
Рис. 3.
а – равномерная коррозия, при которой разрушения распределены по всей поверхности металла;
б – местная коррозия, сосредоточенная на отдельных участках поверхности металла, сопровождающаяся образованием коррозионных каналов, направленных в глубь металла;
в – щелевая или питтинговая коррозия;
г – избирательная коррозия, ведущая к растворению одного из компонентов металлического сплава;
д – межкристаллитная коррозия, ослабляющая связь между металлическими зернами;
е – транскристаллитная коррозия, идущая поперек зерен металла.
Последние пять видов коррозии (б, в, г, д, е) наиболее опасны из-за образования коррозионных каналов, направленных в глубь металла. Воздействие на такой металл механических напряжений ведет к его растрескиванию.
По механизму различают два типа коррозионных процессов: химическую и электрохимическую коррозию.
Химическая коррозия
Основным признаком этой коррозии является отсутствие в коррозионной среде конденсационной влаги. Поэтому этот тип коррозии нередко называют коррозией сухими газами или термической коррозией. При химической коррозии протекает химическая окислительно-восстановительная реакция между металлом и окислителем (коррозионным агентом) из внешней среды. При этой реакции поверхность металла окисляется, а коррозионный агент – восстанавливается.
Химической коррозии подвержены детали и узлы машин, работающих при высокой температуре – поршневые двигатели, камеры внутреннего сгорания топлива, химические реакторы и т.д.
При химической коррозии металлов происходит изменение состава поверхности металла. Рассмотрим это на примерах коррозии металла газами.
Химическая коррозия стали в среде воздуха или кислорода
В большинстве случаев активным коррозионным агентом является кислород:
Fe+ O2 ® FeO + Fe2O3 + Fe3O4
Сталь представляет собой сплав железа и углерода. Углерод находится в стали в виде зерен карбида железа (Fe3C). При коррозии протекают следующие химические реакции на поверхности металла:
2Fe + O2 ↔2FeO(тв)
FeO(тв) ↔ FeO(р-р) процесс растворения оксида в металле, смещающий равновесие предыдущей реакции в сторону образования твердого оксида железа, способствующий продолжению коррозии.
FeO(р-р) + Fe3C → 4Fe + CO↑ происходит выгорание углерода с поверхности металла.
Коррозионно-активными, кроме кислорода, являются продукты сгорания топлива CO2, H2O, CO, SO2.
Химическую коррозию стали в среде углекислого газа можно показать следующими реакциями:
Fe + CO2 ↔ FeO(тв) + CO
FeO(тв) ↔ FeO(р-р)
Fe3C + CO2 ↔ 3Fe + 2CO
В результате происходит межкристаллитная коррозия.
Химическая коррозия стали в среде горячего водяного пара.
Fe + H2O → FeO(тв) + H2
FeO(тв) ↔ FeO(р-р)
H2 →2H(р-р)
Fe3C + H2O→ 3Fe + CO +H2
В этом случае водород, растворяясь в стали, делает ее поверхность хрупкой, что особенно опасно для тонкостенных конструкций. Этот процесс носит название водородное охрупчивание стали, давление водорода создает в микрополостях металла зоны механических напряжений, порождающих микротрещины, в результате чего возникает транскристаллитная коррозия.
Химическую коррозию можно наблюдать при контакте металла с неводными средами, например, при контакте нефти или ее продуктов с поверхностью стальных цистерн. В составе нефти находятся органические соединения, особенно опасны соединения, содержащие хлорид-ионы и серу, они образуют легко растворимые хлориды и сульфиды металлов.
Химическая коррозия стали в неводных средах:
2R- Cl + Me → MeCl2 + R-R
R1-S-R2+ Me →MeS + R1-R2
Разрыв ковалентных связей, способствующий переходу хлорида и сульфида в ионное состояние, совершается легче при повышенных температурах.
В камерах внутреннего сгорания топлива присутствует химический тип коррозии металла, часто называемый ванадиевой коррозией по названию коррозионного агента – пятиокиси ванадия (V2O5) в составе жидкого топлива, например, дизельного. В этом случае коррозия описывается следующими реакциями:
Fe + V2O5 → FeO + V2O4, образуемая при этом четырехокись ванадия является катализатором дальнейшей коррозии стали, так как вновь окисляется до пятиокиси ванадия по реакции:
V2O4 +  О2 → V2O5
О2 → V2O5
