Термодинамика и механизм процесса растворения
Растворение – сложный физико-химический процесс, включающий три основные стадии, каждая из которых характеризуется изменениями термодинамических функций DН и DS:
1) разрушение химических и межмолекулярных связей в растворяемом веществе (например, разрушение кристаллической решетки): DН1>0, DS1>0
2) химическое взаимодействие частиц растворенного вещества с растворителем (сольватация): DН2<0, DS2<0
3) равномерное распределение частиц растворенного вещества в среде растворителя путем диффузии: DН3>0, DS3>0
Согласно 2-му закону термодинамики условием самопроизвольности процесса растворения является убыль энергии Гиббса:
DG = DH - TDS < 0,
которая складывается из энтальпийного DН и энтропийного TDS факторов.
Растворение газов в жидкостях приводит к упорядочению системы и, следовательно, сопровождается уменьшением энтропии: DSр-ния<0. Движущей силой процесса растворения в этом случае является энтальпийный фактор и растворение большинства газов является процессом экзотермическим: DНр-ния<0. Таким образом, самопроизвольное растворение газов возможно при низких температурах (|DН| > |TDS|)
Растворение жидких и твердых веществ в жидкостях приводит к увеличению беспорядка в системе и увеличению энтропии: DSр-ния>0. Суммарный тепловой эффект процесса растворения определяется в основном слагаемыми DН1 и DН2 и в зависимости от их соотношения может и быть и положительным (NaCl), и отрицательным (NaOH). Растворение большинства кристаллических веществ – процесс эндотермический DНр-ния>0, так как энергия, затрачиваемая на разрушение кристаллической решетки не компенсируется энергией, выделяемой за счет сольватации. Таким образом, самопроизвольному растворению большинства твердых веществ способствуют высокие тепмературы (|DН| < |TDS|).
Растворы, образование которых не сопровождается изменениями объема системы и тепловыми эффектами (DV=0, DН=0), называют идеальными. Движущей силой образования идеального раствора является увеличение энтропии системы. Идеальный раствор – понятие абстрактное. Реальные системы могут лишь приближаться к идеальным. Наиболее близки к модели идеального раствора системы, в которых компоненты близки по свойствам и практически не взаимодействуют друг с другом (например, раствор толуола в бензоле). Приближаются по свойствам к идеальным бесконечно разбавленные растворы, в которых взаимодействиях сводятся к минимуму за счет низкой концентрации растворенного вещества.
Растворимость
Под растворимостью понимают концентрацию растворенного вещества в насыщенном растворе.
Растворимость выражают в тех же единицах, что и концентрацию. Часто используют коэффициент растворимости s, равный массе растворенного вещества (г) в насыщенном растворе, содержащем 100 г растворителя.
Насыщенным называют раствор, который находится в равновесии с избытком растворяемого вещества (DGр-ния=0). Насыщенный раствор имеет максимально возможную в данных условиях концентрацию.
Растворимость зависит:
- от природы растворенного вещества и растворителя;
- от температуры;
- от давления;
- от присутствия третьих компонентов.
Влияние природы компонентов на растворимость определяется принципом: подобное растворяется в подобном. Полярные растворители, например, вода, хорошо растворяют вещества с ионной связью (неорганические соли, кислоты и основания). Хорошей растворимостью в воде обладают полярные органические соединения, образующие с молекулами растворителя водородные связи (спирты, карбоновые кислоты, амины). Неполярные растворители, например, углеводороды, растворяют неполярные и малополярные соединения (жиры).
Влияние температуры на растворимость зависит от теплового эффекта растворения и определяется принципом Ле Шателье. Повышению растворимости газов способствует понижение температуры, так как растворение газов – процесс экзотермический. Растворимость большинства твердых веществ и жидкостей - процесс эндотермический и возрастает при повышении температуры.
Влияние давления существенно только в том случае, если при растворении происходит значительное изменение объема системы, что наблюдается при растворении газов в жидкостях. Растворимость газов растет с увеличением давления, так как сопровождается уменьшением объема системы.
Закон Генри:
Количество газа, растворенного в определенном объеме жидкости при постоянной температуре прямо пропорционально давлению газа.
c(X) = Kг p(X)
где c(X) – молярная концентрация газа,моль/л
Kг - константа Генри, моль/лžПа
p(X) – давление газа над раствором, Па
Влияние присутствия третьих компонентов.
Растворимость газов в жидкостях значительно снижается в присутствии электролитов (солей) Этот процесс называют высаливанием.
Закон Сеченова:
Растворимость газов в жидкостях в присутствии электролитов понижается.
С(X) = С0(X)ž 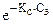
где С(X) – растворимость газа в присутствии электролита
С0(X) – растворимость газа в чистом растворителе
КС - константа Сеченова
Сэ - концентрация электролита
Биологическое значение законов Генри и Сеченова.
Изменение растворимости газов в крови при изменении давления может привести к тяжелым заболеванием. Кесонная болезнь у водолазов – проявление закона Генри. В соответствии с законом Сеченова растворимость кислорода и углекислого газа в крови зависит от концентрации электролитов, а также белков, липидов и других веществ.
