Химическая кинетика. Химическое равновесие. Правило Ле Шателье-Брауна.
Характер смещения под влиянием внешних воздействий можно прогнозировать, применяя принцип Ле Шателье: если на систему, находящуюся в равновесии оказывается воздействие извне, то равновесие в системе смещается так, чтобы ослабить внешнее воздействие.
1.Влияние концентраций:
Повышение концентрации одного из реагирующих веществ смещает равновесие в сторону расходования вещества. Понижение концентрации - в сторону образования вещества.
2.Влияние температуры:
Повышение температуры смещает равновесие в сторону реакции, идущей с поглощением теплоты (эндотермической), а понижение температуры смещает равновесие в сторону реакции, идущей с выделением теплоты (экзотермической).
3. Влияние давления:
Повышение давления смещает равновесие в сторону реакции, идущей с уменьшением объема и, наоборот, понижение давления - в сторону реакции, идущей с увеличением объема.
Пример 1: Как сместится химическое равновесие при синтезе аммиака в экзотермической реакции?
Решение: При повышении температуры в экзотермической реакции
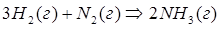
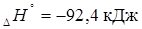
реакция протекает с выделением теплоты, равновесие должно сдвигаться влево (в сторону исходных веществ).
Скорость реакции:
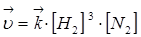 | ||
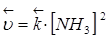 |
При увеличении давления в три раза концентрация веществ увеличивается также в три раза:

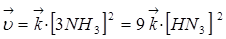
Такое изменение концентрации увеличивает скорость прямой реакции в 81 раз, а обратное в 9 раз, т.е. при увеличении давления в три раза состояние равновесия достигается быстрее в 81 : 9 = 9 раз.
В левой части уравнения участвуют 3+1=4 моль вещества, а в правой части уравнения получается 2 моль, поэтому увеличение давления приводит к повышению выхода целевого продукта, что подтверждает принцип Ле Шателье.
Фазовые равновесия.
 Равновесие процесса перехода одной фазы в другую без изменения химического состава называется фазовым равновесием. Примерами фазового равновесия могут быть следующие процессы:
Равновесие процесса перехода одной фазы в другую без изменения химического состава называется фазовым равновесием. Примерами фазового равновесия могут быть следующие процессы:
 | |||||
 | |||||
 |
Для фазового равновесия соблюдается принцип Ле Шателье.
При повышении температуры равновесие смещается в сторону эндотермического процесса, например, плавления и испарения. С увеличением давления равновесие смещается в сторону процессов, при которых газ или пар превращаются в жидкое или твёрдое состояние.
Правило фаз.
Сформулировано Дж. Гиббсом. Число степеней свободы C, фаз Ф, независимых компонентов К и внешних условий н, влияющих на равновесие, взаимосвязаны соотношением:
C + Ф = К + н
2.4.Механизм химической реакций. Цепные реакции. Фотохимические процессы. Гомогенный и гетерогенный катализ. Автокатализ. Ферментативный катализ. Каталитические яды. Колебательные реакции.
Энергия активации. Энергетический профиль реакции.
Реакции происходят в результате непосредственного столкновения молекул. Однако не все столкновения приводят к химическому взаимодействию. Образованию новых веществ способствуют только молекулы, обладающие достаточным запасом энергии. Такие молекулы называются активными молекулами. Та минимальная энергия, достаточная для начала химической реакции называется энергией активации и выражается в ккал или кДж. Чем меньше энергия активации, тем быстрее идет реакция.
В реакциях, где энергия активации больше, чем 150 кДж при t=25°С скорость очень мала или практически эти реакции не протекают. В реакциях, где энергия активации меньше 60 кДж, скорость очень большая (взрыв).
Величина энергии активации Еа зависит от природы реагирующих элементов и служит характеристикой каждой реакции.
 |
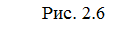
Энергетическая диаграмма хода реакции с образованием
активированного комплекса.
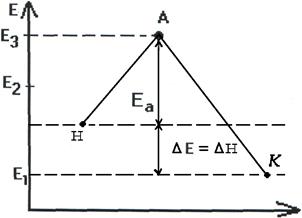
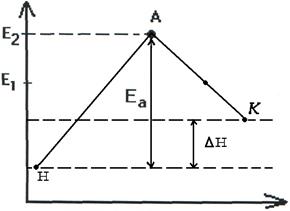
Чтобы реагирующие вещества А и В образовали продукты реакции С и Д они должны преодолеть энергетический барьер МL. На это затрачивается энергия активации Еа. При этом в ходе реакции из частиц реализующих веществ, образуется промежуточная неустойчивая группировка - активированный комплекс (рис.2.6).
Этот комплекс распадается с образованием конечных продуктов, причем выделяется такое количество энергии, которое позволяет конечным продуктам спуститься до уровня средней энергии конечных продуктов.
Т.о. изменение продуктов можно выразить в виде схем для эндотермической и экзотермической реакции (рис.2.7, 2.8).
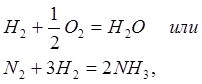 |
Обычно реакции между веществами с прочными ковалентными связями характеризуются большими значениями Еа и идут медленно. Это относится ко многим взаимодействиям, как
скорость которых при стандартных условиях равна 0.
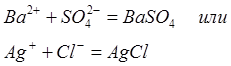 Малыми значениями Еа и очень большими скоростями характеризуются ионные взаимодействия в растворах
Малыми значениями Еа и очень большими скоростями характеризуются ионные взаимодействия в растворах
Катализ
Общие понятия.
Катализом называется ускорение скорости реакции в присутствии специфических веществ, количество которых в ходе реакции не изменяется.
Эти вещества только ускоряют скорость реакции, но не расходуются в результате ее протекании.
Катализаторы могут участвовать в образовании промежуточных продуктов реакции, но к концу взаимодействия полностью регенерируются.
Замедление реакций осуществляется при помощи ингибиторов(отрицательных катализаторов).
– При катализе не изменяется величина теплового эффекта реакции.
– Если катализируемая реакция обратима, катализатор не влияет на равновесие, не меняет Кр и равновесных концентраций компонентов системы. Он в равной степени ускоряет прямую и обратную реакцию.
– Катализаторы действуют избирательно, селективно.
Катализатор, активно ускоряющий одно взаимодействие, безразличен к другому.
Из одних и тех же веществ можно получить различные продукты, применяя разные катализаторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора их называют каталитическими ядами – соединения мышьяка, свинца, цианида.
Добавки, увеличивающие активность катализатора называют промоторами.
Активность, селективность и срок службы катализатора во многом зависит от температуры каталитической реакции.
Существуют катализаторы, не обладающие специфичностью, их называют универсальными. К ним относятся металлические Nl, Pt, палладий, которые катализируют процессы гидрирования, окисления. Многие процессы являются автокаталитическими. В этих реакциях катализатором служит один из продуктов.
Цепные реакции
Под цепными реакциями понимают такие химические реакции, в которых появление промежуточно-активной частицы вызывает большое число (цепь) превращений исходныхмолекул.
В качестве активной частицы выступают свободные атомы, возбужденные молекулы –радикалы – частицы, имеющие один неспаренный электрон.
Большую роль в создании учения цепных реакций сыграли работы
Н. Н. Семенова и С. Хиншельвуда, которые за исследования в этой области получили Нобелевскую премию (1956 г).
Цепные реакции составляют основу многих практически важных процессов (крекинга, полимеризации, сгорания топлива и т. п.).
Различают 3 типа цепных реакций:
1С неразветвленными цепями
2С разветвленными цепями
3С вырожденно-разветвленными
Каждый тип реакций включает 3 этапа - зарождение цепей, их развитие и обрыв. Химические процессы с неразветвленными цепями можно рассмотреть на примере взаимодействия между водородом и хлором:
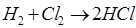
Подумайте, какая молекула - водорода или хлора - может распасться на атомы. Энергия связи молекулы водорода равна 436 кДж/моль, хлора 243. Конечно, будет происходить распад молекулы хлора.
Если смесь 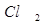 и
и 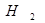 храниться в темноте, то указанная реакция при обычных температурах не протекает. Для бурного течения этой реакции достаточно ввести в смесь ничтожное количество паров металлического натрия.
храниться в темноте, то указанная реакция при обычных температурах не протекает. Для бурного течения этой реакции достаточно ввести в смесь ничтожное количество паров металлического натрия.
Схему реакции по этапам можно записать так:
а) 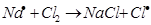 зарождение цепи
зарождение цепи
 б)
б) 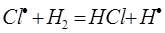
в) 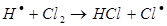
г) 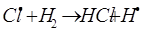
 д)
д) 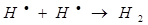
е) 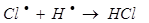
ж) 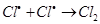
На первом этапе в реакциях зарождения цепей (а) образуется активная частица – свободный радикал или атом (С1). Большая скорость цепных реакций объясняется высокой реакционной способностью активных частиц.
На втором этапе развития реакций (б-г) активная частица реагирует с молекулой исходного вещества с образованием молекулы продукта с новой активной частицей. Регенерированная новая частица снова реагирует с молекулой и т. д. Таким образом, образуется неразветвленная цепь с
большим числом звеньев.
Энергия активации взаимодействия радикалов или атомов с молекулами не превышает 40 кдж/моль. Длина цепи из элементарных химических реакций достигает 10 тысяч и сотен тысяч звеньев.
На третьем этапе происходит обрыв цепей (д-ж). Она происходит в результате соединения (рекомбинации) атомов в объеме реактора, захвата его стенкой с последующей рекомбинацией на стенки, образованием неактивного радикала при взаимодействии активных частиц с примесями (они играют роль ингибиторов).
Фотохимические реакции.
К фотохимическим реакциям относятся реакции, протекающие под действием квантов света. Такие реакции многочисленны, а некоторые из них имеют жизненно важное значение.
Фотохимические реакции – реакции выделения кислорода и ассимиляции 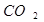 в процессе фотосинтеза, образование озона из кислорода под действием ультрафиолетового излучения солнца, природный синтез хлорофилла,. фотохимическое разложение бромистого Ag .
в процессе фотосинтеза, образование озона из кислорода под действием ультрафиолетового излучения солнца, природный синтез хлорофилла,. фотохимическое разложение бромистого Ag .
Тема 3. Растворы
3.1 Дисперсные растворы. Классификация дисперсных систем. Суспензии. Эмульсии. Коллоидные растворы. Истинные растворы. Общие свойства растворов. Растворимость. Способы выражения концентрации растворов. Энергетика процесса растворения. Разбавленные растворы неэлектролитов. Законы Рауля.
В природе химические соединения в индивидуальном состоянии практически не встречаются. Часто они находятся в виде смеси друг с другом, в виде водных растворов, образуя химические системы.
