Слабая кислота и соль слабой кислоты, образованная сильным основанием
Учение о растворах
1. Для какого вещества фактор эквивалентности (fэ) равен единице?
1) Na2SO4
2) NaNO3
3) СaCl2
4) Na2CO3
5) Na3PO4
2. Для какого вещества фактор эквивалентности (fэ) равен 1/2?
1) ВаSO4
2) NaNO3
3) NaCl
4) NaBr
5) Na3PO4
3. Для какого вещества фактор эквивалентности (fэ) равен 1/3?
1) Na2CO3
2) Na3PO4
3) NaNO3
4) Ca(OH)2
5) Al2(SO4)3
4. Для какого вещества фактор эквивалентности (fэ) равен 1/6?
1) Al(OH)3
2) Na3PO4
3) Al2(SO4)3
4) CaCl2
5) Mg(NO3)2
5. Какая концентрация измеряется в моль/кг?
1) молярная концентрация
2) молярная концентрация эквивалента
3) моляльная концентрация
4) массовая доля
5) мольная доля
6. По какому соотношению рассчитывается молярная концентрация?
1) 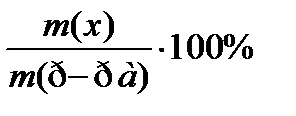
2) 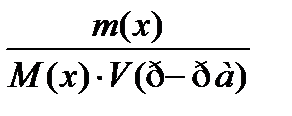 +++++
+++++
3) 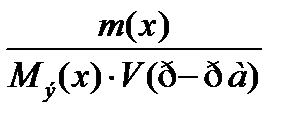
4) 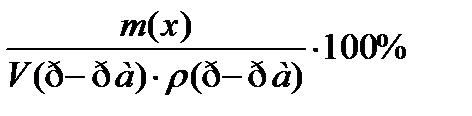
5) 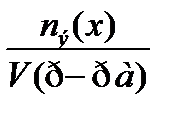
7. По какому соотношению рассчитывается молярная концентрация эквивалента?
1) 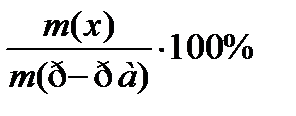
2) 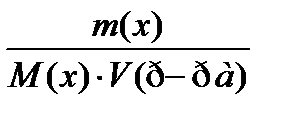
3) 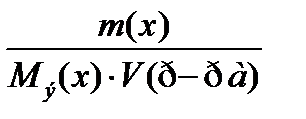 ++++
++++
4) 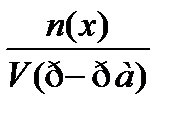
5) 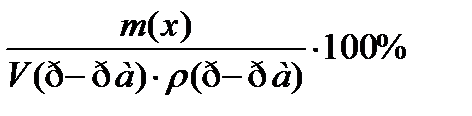
8. По какой формуле рассчитывается массовая доля раствора?
1) 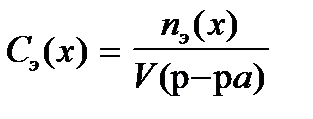
2) 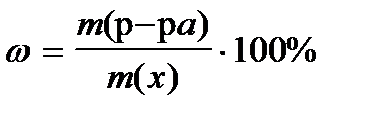
3) 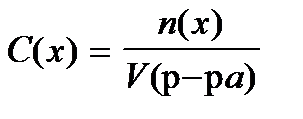
4) 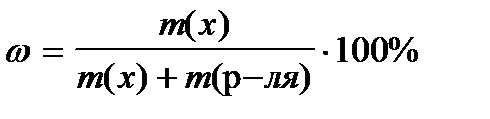 +++++
+++++
5) 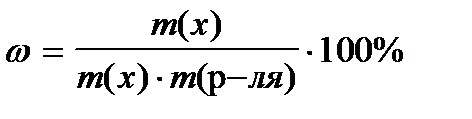
9. В 1 литре содержится 3,65 г хлороводорода. Чему равна молярная концентрация этого раствора?
1) 1 моль/л
2) 0,5 моль/л
3) 0,1 моль/л
4) 0,05 моль/л
5) 0,01 моль/л
10. В хирургии применяются гипертонические марлевые повязки, пропитанные 10%-ным водным раствором хлорида натрия. Сколько г соли и воды нужно взять для приготовления 500 г такого раствора?
1) 5 и 495
2) 10 и 490
3) 25 и 475
4) 50 и 450
5) 75 и 425
11. В 95 г воды растворили 5 г глюкозы. Чему равна массовая доля глюкозы (%) в полученном растворе?
1) 5,00
2) 5,26
3) 5,56
4) 5,88
5) 6,00
12. Повышение температуры кипения раствора по сравнению с температурой кипения чистого растворителя
1) равно нулю
2) прямо пропорционально массовой доле растворенного вещества
3) прямо пропорционально мольной доле растворенного вещества
4) прямо пропорционально моляльности раствора
5) не зависит от концентрации растворенного вещества
13. Что означает запись «3%-ный раствор Н2О2»?
1) в 1 литре раствора содержится 3 г пероксида водорода
2) в 1000 г раствора содержится 3 г пероксида водорода
3) в 100 г раствора содержится 3 г пероксида водорода
4) в 100 г раствора содержится 3 моль пероксида водорода
5) в 1000 г растворителя содержится 3 г пероксида водорода
14. Эбуллиоскопическая константа воды 0,52о. Чему равна температура кипения водного раствора глюкозы, моляльная концентрация которого равна 1 моль/кг?
1) 100оС
2) 100,52оС
3) 101,04оС
4) 99,48оС
5) 98,96оС
15. Какой раствор гипертоничен по отношению к плазме крови?
1) 0,1%-ный раствор NaCl
2) 10%-ный раствор NaCl
3) 0,15 М раствор NaCl
4) 0,9%-ный раствор NaCl
5) 0,01 М раствор NaCl
16. Какой раствор является изотоническим по отношению к плазме крови?
1) 1 М раствор NaCl
2) 10%-ный раствор NaCl
3) 0,01%-ный раствор NaCl
4) 0,9%-ный раствор NaCl
5) 0,01 М раствор NaCl
17. Какой раствор гипотоничен по отношению к плазме крови?
1) 1 М раствор NaCl
2) 10%-ный раствор NaCl
3) 0,15 М раствор NaCl
4) 0,9%-ный раствор NaCl
5) 0,01%-ный раствор NaCl
18. Упругость клеток, обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена наличием осмотического давления. Как называется это явление?
1) лизис
2) тургор
3) гемолиз
4) плазмолиз
5) деплазмолиз
19. При помещении эритроцитов в гипертонический раствор происходит их набухание и разрыв оболочек. Как называется это явление?
1) диализ
2) тургор
3) гемолиз
4) плазмолиз
5) деплазмолиз
20. При помещении клеток в гипотонический раствор происходит их сжатие, сморщивание. Как называется это явление?
1) лизис
2) тургор
3) гемолиз
4) плазмолиз
5) деплазмолиз
21. Какие растворы могут быть использованы для внутривенных инъекций?
1) пересыщенные
2) гипертонические
3) изотонические
4) гипотонические
5) насыщенные
22. Водный раствор какого из перечисленных ниже веществ имеет максимальную температуру замерзания, при условии, что молярные концентрации эквивалента этих растворов одинаковы?
1) С6Н12О6
2) NaNO3
3) Ca(NO3)2
4) Al(NO3)3
5) Al2(SO4)3
23. Водный раствор какого из перечисленных ниже веществ имеет минимальную температуру замерзания, при условии, что молярные концентрации эквивалента этих растворов одинаковы?
1) С6Н12О6
2) КNO3
3) Mg(NO3)2
4) Fe(NO3)3
5) Al2(SO4)3
24. При одинаковой температуре растворы с молярной концентрацией 0,1 моль/л изотоничны друг другу. Для какой пары растворов будет соблюдаться это условие?
1) фруктоза и хлорид натрия
2) хлорид натрия и сульфат натрия
3) сахароза и хлорид магния
4) нитрат кальция и сульфат натрия
5) хлорид калия и сульфат калия
25. Как называется часть осмотического давления, обусловленная наличием в растворе высокомолекулярных компонентов?
1) давление насыщенного пара над чистым растворителем
2) давление насыщенного пара растворителя над раствором
3) систолическое давление
4) диастолическое давление
5) онкотическое давление
26. Какая группа веществ имеет одинаковое значение фактора эквивавалентности?
1) КСl, Са(ОН)2, H2SO4
2) А1(ОН)3, Н2СО3, NаВг
3) AlI3, Fe(ОН)3, СrСl3
4) Сr(ОН)3, FеSO4, НСl
5) КСl, Аl(ОН)3, FеSO4
27. Как называется раствор с осмотическим давлением большим, чем в стандарте?
1) гипотонический
2) изотонический
3) физиологический
4) насыщенный
5) гипертонический
28. Какое явление наблюдается при помещении эритроцитов в 10%-ный раствор хлорида натрия?
1) гемолиз
2) плазмолиз
3) деплазмолиз
4) ультрафильтрация
5) эндосмос
29. Какое явление наблюдается при помещении эритроцитов в 0,1%-ный раствор хлорида натрия?
1) гемолиз
2) плазмолиз
3) диализ
4) коагуляция
5) экзосмос
30. Растворы пересчисленных ниже солей имеют одинаковую молярную концентрацию 0,01 моль/л. Какая пара растворов содержит одинаковое число частиц в 1 литре раствора?
1) Na2SO4 и NaCl
2) Na2CO3 и NaBr
3) NaBr и K2SO4
4) + NaCl и KBr
5) NaCl и Na3PO4
31. Молярная масса CaSO4 равна 136 г/моль. Чему равна молярная масса эквивалента CaSO4 (г/моль)?
1) 272
2) 136
3) 96
4) 68
5) 40
32. Молярная масса эквивалента NaOH равна 40 г/моль. Чему равна молярная масса NaOH (г/моль)?
1) 120
2) 80
3) 40
4) 20
5) 10
33. Молярная масса эквивалента Al(OH)3 равна 26 г/моль. Чему равна молярная масса Al(OH)3 (г/моль)?
1) 130
2) 78
3) 39
4) 26
5) 13
34. г/моль - это единица измерения каких величин?
1) масса навески
2) молярная концентрация
3) молярная масса эквивалента
4) молярная концентрация эквивалента
5) моляльная концентрация
35. Количество вещества можно рассчитать как отношение
1) молярной массы вещества к его массе
2) массы вещества к его молярной массе
3) молярной массы эквивалента вещества к его массе
4) массы вещества к его молярной массе эквивалента
5) массы вещества к массе раствора
36. Количество вещества эквивалента можно рассчитать как отношение
1) молярной массы вещества к его массе
2) массы вещества к его молярной массе
3) молярной массы эквивалента вещества к его массе
4) массы вещества к его молярной массе эквивалента
5) массы вещества к массе раствора
37. Какую величину можно рассчитать как произведение фактора эквивалентности и молярной массы вещества?
1) массовую долю
2) молярную концентрацию
3) молярную концентрацию эквивалента
4) молярную массу эквивалента
5) мольную долю
38. Какая величина представляет собой отношение количества растворенного вещества к объему раствора?
1) молярная концентрация
2) молярная концентрация эквивалента
3) массовая доля
4) мольная доля
5) моляльная концентрация
39. Какая величина представляет собой отношение количества вещества эквивалента растворенного вещества к объему раствора?
1) молярная концентрация
2) молярная концентрация эквивалента
3) массовая доля
4) мольная доля
5) моляльная концентрация
40. Какая величина представляет собой отношение количества растворенного вещества к массе растворителя?
1) молярная концентрация
2) молярная концентрация эквивалента
3) массовая доля
4) мольная доля
5) моляльная концентрация
Буферные растворы
1. По какой формуле можно рассчитать концентрацию ионов водорода в растворе сильной одноосновной кислоты?
1) [H+] = Cк-ты
2) [H+] = Cк-ты - [OH-]
3) [H+] = 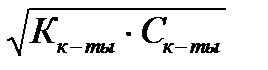
4) [H+] = 14 - [OH-]
5) [H+] = [OH-]
2. Какое утверждение верно для нейтрального раствора?
1) [H+] = [OH-]
2) [H+] = 14 - [OH-]
3) [H+] < [OH-]
4) [H+] × [OH-] = 14
5) [H+] > [OH-]
3. Какой компонент гидрокарбонатного буферного раствора будет реагировать при добавлении небольшого количества хлороводородной кислоты?
1) H2CO3
2) NaHCO3
3) Na2CO3
4) CaCO3
5) K2CO3
4. По какому уравнению можно рассчитать концентрацию ионов водорода в ацетатном буферном растворе?
1) 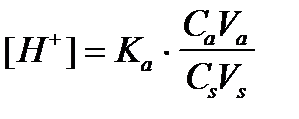 +++
+++
2) 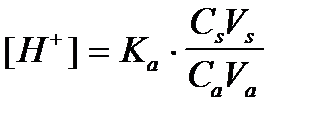
3) 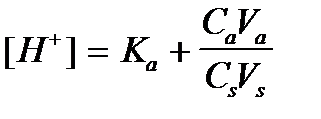
4) 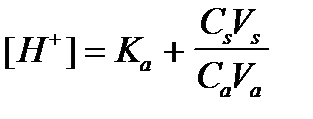
5) 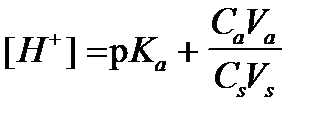
5. Какие соединения входят в состав гидрокарбонатного буферного раствора?
1) H2CO3 и NaHCO3
2) Na2CO3 и K2CO3
3) Na3PO4 и Na2HPO4
4) CaCO3 и H2CO3
5) K2CO3 и CaCO3
6. Какие соединения входят в состав фосфатного буферного раствора?
1) Na3PO4 и H3PO4
2) Na2HPO4 и NaH2PO4
3) NaH2PO4
4) Na3PO4 и Na2НPO4
5) Ca3(PO4)2
7. Какие соединения входят в состав аммиачного буферного раствора?
1) NH4NO3 и (NH4)2SO4
2) (NH4)2CO3 и NH4Cl
3) NH4Cl и NH4OH
4) (NH4)2SO4
5) NH4OH и HCl
8. В каком водном растворе соблюдается соотношение [H+] < [OH-]?
1) NaOH
2) KCl
3) HCl
4) CH3COOH
5) H3PO4
9. В каком водном растворе соблюдается соотношение [H+] > [OH-]?
1) NaOH
2) KOH
3) HCl
4) KCl
5) NH4OH
10. Чему равна концентрация ионов [H+] в чистой воде при 25°С (моль/л)?
1) 10-14
2) 10-7
3) 107
4) 101
5) 7
11. Чему равна концентрация Сон-, если Сн+ = 10-4?
1) 14
2) 10-14
3) 10-7
4) 10-10
5) 10-4
12. Как можно рассчитать водородный показатель рН в водных растворах?
1) –ln Cн+
2) –lg Cн+
3) lg Cн+
4) ln Cн+
5) –logВ C
13. Чему равна сумма рН и рОН для разбавленных водных растворов?
1) 10-14
2) 10-7
3) 1
4) 7
5) 14
14. Какое условие соблюдается в нейтральном водном растворе?
1) [Н+] > 10-7
2) [Н+] < 10-7
3) [Н+] = 10-7
4) pH = 14
5) pH = 1
15. Как называется смещение реакции среды в организме в кислую сторону?
1) осмос
Ацидоз
3) алколоз
4) гидролиз
5) нейтрализация
16. Как называется смещение реакции среды в организме в щелочную сторону?
1) ацидоз
Алколоз
3) гидролиз
4) гомеостаз
5) нейтрализация
17. Чему равна концентрация ионов водорода (моль/л) в водном растворе с рОН =11?
1) 10-1
2) 10-3
3) 10-5
4) 10-9
5) 10-11
18. Из каких компонентов состоит кислотный буферный раствор?
1) сильная кислота
2) сильное основание
Щелочная
3) слабощелочная
4) слабокислая
5) нейтральная
21. Чему равен рН раствора гидроксида натрия с СNаОН = 0,001 моль/л?
1) 10-2
2) 2
3) 9
4) 11
5) 10-12
22. Какое соотношение справедливо для раствора HCl с концентрацией 0,1 моль/л ?
1) [H+] = [OH-]
2) [H+] < [OH-]
3) pH = 1
4) pOH = 1
5) [H+] = 10-13
23. Какое значение принимает водородный показатель рН в кислых растворах?
1) рН = 7
2) рН > 7
3) рН > 9
4) рН = 14
5) рН < 7
24. Для водного раствора какого вещества выполняется условие [H+] > [OH-]?
1) NaOH
2) KOH
3) NaCl
4) CH3COOH
5) NH4OH
25. По какой формуле можно рассчитать концентрацию ионов водорода в растворе уксусной кислоты?
1) [H+] = Cк-ты
2) [H+] = a×Кк-ты
3) [H+] = 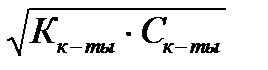 +++
+++
4) [H+] = 14 - [OH-]
5) [H+] = 10-14
26. По какой формуле можно рассчитать концентрацию ионов водорода в растворе гидроксида аммония?
1) [H+] = Cосн
2) [H+] = a×Cосн
3) [H+] = 10-14 - [OH-]
4) [H+] = 14 - [OH-]
5) [H+] = 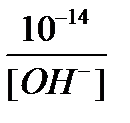
27. Для раствора КОН с концентрацией 0,01 моль/л верно
1) [H+] = [OH-]
2) [H+] > [OH-]
3) [H+] < [OH-]
4) [H+] = 10-2
5) [OH-] = 10-12
28. Для раствора КОН с концентрацией 0,001 моль/л верно утверждение
1) рН = 3
2) рОН = 11
3) рОН = 3
4) [H+] = 10-3
5) [OH-] = 10-11
29. Чему равна константа ионизации Kb для раствора слабого однокислотного основания с концентрацией 0,1 моль/л и степенью ионизации a=0,001?
1) 10-1
2) 10-3
3) 10-4
4) 10-5
5) 10-7
30. Чему равна степень ионизации a для раствора слабого однокислотного основания с концентрацией 0,1 моль/л и константой ионизации Kb равной 10-7?
1) 0,1
2) 0,01
3) 0,001
4) 10-4
5) 10-5
31. Как называется постоянная Кв = Сн+ . Сон- ?
1) константа скорости
2) степень диссоциации
3) константа равновесия
4) константа диссоциации
5) ионным произведением воды
32. Чему равно ионное произведение Кв чистой воды при 25 оС ?
1) 10-14
2) 10-7
3) 10+7
4) 1014
5) 14
33. Какая величина остается постоянной при добавлении небольшого количества сильных кислот или оснований к буферным растворам?
1) объем раствора
2) рН раствора
3) ионная сила раствора
4) коэффициент активности ионов
5) суммарная концентрация всех ионов
34. Постоянство реакции среды организмов обеспечивается наличием в них
1) буферных систем
2) воды
3) сильной кислоты
4) ионов натрия
5) ионов калия
35. Как называется объемная доля химически связанного СО2 в 100 мл плазмы крови?
1) щелочным резервом крови,
2) водородным показателем крови,
3) осмотическим давлением крови,
4) буферной емкостью крови,
5) концентрацией крови.
36. В каком растворе Сн+ = Сон- = 10-7?
1) кислом
2) щелочном
3) слабощелочном
4) слабокислом
5) нейтральном
Комплексные соединения
1. Чему равна степень окисления комплексообразователя в ионе [Co(CN)4(H2O)2]-?
1) +4
2) +5
3) +3
4) +6
5) +2
2. Чему равна степень окисления комплексообразователя в частице [CrCl2CN(H2O)3]?
1) +3
2) +6
3) +4
4) +5
5) +2
3. Чему равен заряд комплексной частицы [Co(NO2)3(NH3)2]x, в которой комплексообразователем является Со (III)?
1) 3+
2) 3 –
3) 0
4) 2 –
5) 1+
4. Чему равен заряд комплексного иона [PtCl(OH)5]x, в котором комплексообразователем является Pt (IV)?
1) 2+
2) 2 –
3) 4+
4) 3 –
5) 3+
5. Какая формула соответствует комплексному соединению монобромопентанитроплатинат (IV) калия?
1) K[PtBr(NO2)5]
2) [PtBr(NO2)5]K
3) K2[Pt(NO2)5Br]
4) [Pt(NO2)5]KBr
5) [KBr][Pt(NO2)5]
6. Какая формула соответствует комплексному соединению пентацианомоноамминферрат (II) натрия?
1) Na[Fe(CN)5NH3]
2) Na2[Fe(CN)6NH3]
3) Na(NH3)[Fe(CN)6]
4) [Fe(CN)6NH3]Na
5) Na3[Fe(CN)5NH3]
7. Какая формула соответствует комплексному соединению сульфат пентаамминбромокобальта (III)?
1) [CoBr(NH3)5]SO4
2) [CoBr][(NH3)5·SO4]
3) [Co(NH3)5]BrSO4
4) (NH3)5[CoBrSO4)
5) Co[Br(NH3)5SO4]
8. Чему равна степень окисления золота в комплексном ионе [Au(CN)2Br2]-?
1) +3
2) +4
3) +5
4) +6
5) +2
9. Какая формула соответствует катионному комплексу?
1) Ca[Al(OH)5H2O]
2) [Co(NH3)3(NO2)3]
3) [PtCl3(NH3)3]
4) [Cr(CNS)2H2O(NH3)3]Br
5) Ca[Al(OH)5H2O]
10. Какая формула соответствует анионному комплексу?
1) [CrOH(H2O)2(NH3)3]Br2
2) [CrCl(NH3)5]Cl2
3) Ba2[Fe(CN)6]
4) [CoBr(NH3)5]SO4
5) [PtCl4(NH3)2]
11. Какая формула соответствует нейтральному комплексу?
1) K2[PtCl6]
2) [Co(NO2)2(NH3)3]Cl
3) [PtCl(NH3)3]Cl
4) [PtCl3(NH3)3]Br
5) [PtCl4(NH3)2]
12. Что является комплесообразователем в комплексном соединении [Co(NH3)5Cl]Cl2?
1) Co2+
2) [Co(NH3)5Cl]2+
3) Co3+
4) 5 NH3 и Cl-
5) 2Cl-
13. Что является лигандами в комплексном соединении (NH4)2[Pt(OH)2Cl4]?
1) [Pt(OH)2Cl4]2-
2) Pt4+
3) 4Cl- и 2OH-
4) Pt2+
5) 2NH4+
14. Что является комплесообразователем в комплексном соединении (NH4)2[Pt(OH)2Cl4]?
1) 2OH-
2) Pt2+
3) Pt4+
4) 4Cl-
5) 2NH4+
15. Как называется химическая связь, при образовании которой электроны практически полностью переходят от одного взаимодействующего атома к другому?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
5) металлическая
16. Как называется химическая связь, при образовании которой электроны лишь частично смещаются от одного взаимодействующего атома к другому?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
5) металлическая
17. Как называется химическая связь, при образовании которой электроны в равной степени принадлежат обоим атомам?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
5) металлическая
18. Как называется химическая связь, образованная внешними электронами атомов металла в кристаллической решетке металла?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
5) металлическая
19. Как называется химическая связь, характерная для соединений, содержащих сильно полярные ковалентные связи между атомом водорода и элементом с высокой электроотрицательностью?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
5) металлическая
20. Как называется максимальное число координационных мест, которые способен занимать лиганд?
1) буферная ёмкость
Дентантность
3) ёмкость поглощения
4) теплоёмкость
5) электроёмкость
Строение атома. Биогенные элементы
1. Сколько всего электронов имеет частица Ва2+, если порядковый номер бария равен 56?
1) 58
2) 57
3) 56
4) 55
5) 54
2. Сколько всего электронов имеет частица I-, если порядковый номер иода равен 53?
1) 55
2) 54
3) 53
4) 52
5) 51
3. Сколько всего электронов имеет частица Fe3+ , если порядковый номер железа равен 26?
1) 29
2) 27
3) 26
4) 25
5) 23
4. Какой элемент образует соединения, которые токсичны для человека?
1) кальций
2) натрий
3) магний
4) свинец
5) калий
5. Какой элемент является основой соединений костной ткани?
1) натрий
2) свинец
Кальций
4) калий
5) мышьяк
6. Раствор какого вещества применяют в медицине в качестве антисептического средства?
1) NO2
2) HCl
3) KMnO4
4) ZnCl2
5) NH4OH
7. Раствор какого вещества применяют в медицине для повышения кислотности желудочного сока?
1) НNO3
HCl
3) KMnO4
4) NaHCO3
5) NH4OH
8. Какое вещество применяют в медицине при повышенной кислотности желудочного сока и изжоге?
1) Nа2CO3
2) HCl
3) NaОH
4) NaHCO3
5) NH4OH
9. Какой ион является основным внутриклеточным ионом?
1) К+
2) Na+
3) Ca2+
4) Fe2+
5) Mn7+
10. Какой ион является основным внеклеточным ионом?
1) К+
2) Na+
3) Ca2+
4) Fe2+
5) Mn7+
11. Какой элемент относится к макроэлементам?
К
2) Cs
3) Rb
4) Сu
5) Mn
12. Какой элемент является органогеном?
C
2) Na
3) Ca
4) Fe
5) Mn
13. Какой элемент относится к микроэлементам?
1) C
I
3) Ca
4) O
5) Cl
14. При недостатке в организме какого элемента возникает заболевание «эндемический зоб»?
1) C
I
3) Ca
4) O
5) Mn
15. Какой ион является комплексообразователем в гемоглобине?
1) К+
2) Na+
3) Ca2+
4) Fe2+
5) Mn7+
16. При недостатке в организме какого элемента развивается остеопороз?
1) К
2) Na
3) Ca
4) Fe
5) Mn
17. При недостатке фтора в зубной эмали у человека развивается
1) флюороз
2) рахит
Кариес
4) антракоз
5) силикоз
18. При избытке фтора возникает
1) кариес
2) флюороз
3) антракоз
4) рахит
5) силикоз
19. В результате систематического вдыхания каменноугольной пыли развивается
1) силикоз
2) антракоз
3) алюминоз
4) флюороз
5) кариес
20. При систематическом вдыхании пыли алюминия и его оксида развивается болезнь:
1) антракоз
2) силикоз
3) флюороз
4) алюминоз
5) кариес
22. Кобальт, входящий в состав витамина В12, является
1) s-макроэлементом
2) d-макроэлементом
3) р-макроэлементом
D-микроэлементом
5) s-микроэлементом
22. Цинк, входящий в состав инсулина, является
1) d-макроэлементом
2) s-макроэлементом
3) р-макроэлементом
4) d-микроэлементом
5) s-микроэлементом
Химическая термодинамика
1. Какой термодинамической системой является система «0,9%-ный раствор NaCl в запаянной ампуле»?
1) грубодисперсной
2) гетерогенной
3) изолированной
4) закрытой
5) открытой
2.Какая термодинамическая система является гомогенной?
1) человек
2) растение
Открытая
2) закрытая
3) изолированная
4) гомогенная
5) гетерогенная
5. Какая из нижеперечисленных термодинамических систем является закрытой?
1) человек
2) растение
3) остывающий камень
Идеальный термос
5) живая клетка
6.Какая термодинамическая система (при равном количестве вещества) будет иметь наименьшее значение энтропии?
1) разбавленный раствор глюкозы
2) насыщенный раствор хлорида натрия над осадком
3) воздух
4) жидкий азот
5) кристаллический йод
7. Какая термодинамическая величина является мерой реакционной способности химической системы?
1) внутренней энергии
2) температуры системы
3) теплоты образования продуктов реакции
Энергии Гиббса
5) температуры окружающей среды
8. Как изменяются теплота и энтальпия при протекании эндотермической реакции?
1) Q<0, DН>0
2) Q<0, DН<0
3) Q>0, DH>0
4) Q=0, DH<0
5) Q>0, DН=0
9. Как изменяются теплота и энтальпия при протекании экзотермической реакции?
1) Q<0, DН<0
2) Q>0, DH<0
3) Q>0, DH>0
4) Q<0, DН>0
5) Q=0, DH>0
10. При протекании какой химической реакции, идущей в газовой фазе, энтропия термодинамической системы не изменяется?
1) HCl + NH3 ® NH4Cl
2) C2H5OH + 3O2 ® 2CO2 + 3H2O
3) NI3NH3 ® N2 + ЗНI
4) H2 + Сl2 ® 2НСl
5) 2CO + O2 ® 2CO2
11. При протекании какой химической реакции, идущей в газовой фазе, энтропия термодинамической системы увеличивается?
1) 2N2O + 4O2 ® 2N2O5
2) 3Н2 + N2 ® 2NН3
3) 4НСl + O2 ® 2Сl2 + 2Н2O
4) N2 + О2 ® 2NO
5) 2Н2O2 ® 2H2O + O2
12. Какой термодинамической системой является человек?
1) открытой гомогенной
2) закрытой гетерогенной
3) изолированной гомогенной
Открытой гетерогенной
5) закрытой гомогенной
13. Какие биохимические процессы протекают в клетках живого организма?
1) изобарные
2) изохорные
3) изотермические
4) изохорно-изотермические
Изобарно-изотермические
14. Теплота образования какого вещества равна нулю?
1) NO2
2) NH3
3) N2O
4) HNO3
5)N2
15. как называется величина, равная количеству теплоты, выделяемому или поглощаемому при образовании 1 моль сложного вещества из простых веществ в стандартных условиях?
1) энтальпией сгорания
2) энтальпией нейтрализации
3) стандартной теплотой образования
4) стандартной теплотой разложения
5) стандартной энтальпией образования
16.«Теплота разложения какого-либо химического соединения равна по абсолютной величине и противоположна по знаку теплоте его образования» - это формулировка
1) первого начала термодинамики
2) второго начала термодинамики
3) закона Лавуазье-Лапласа
4) закона Гесса
5) следствия из закона Гесса
17. Какая формула соответствует математическому выражению закона Лавуазье-Лапласа?
1) Q = DU + A
2) DHd = -DHf
3) QV = DU
4) Qp = DH
5) DHd + DHf = 0
18. Чему будет равна энтальпия реакции разложения двух моль воды, если энтальпия реакции образования одного моль воды равна -241,6 кДж?
1) -241,6 кДж
2) +241,6 кДж
3) - 120,8 кДж
4) -483,2 кДж
5) +483,2 кДж
19. «Тепловой эффект химических реакций не зависит от числа промежуточных стадий, а определяется лишь начальным и конечным видом и состоянием системы» - это формулировка
1) первого начала термодинамики
2) второго начала термодинамики
3) закона Лавуазье-Лапласа
4) закона Гесса
5) следствия из закона Гесса
20. По какой формуле определяется тепловой эффект изохорного процесса:
1) Qv=DG - TDS;
2) Qv=DH;
3) Qv=рDV;
4) Qv=U + pV;
5) Qv=DU.
21. Теплота образования какого из приведенных веществ не равна нулю?
1) Cl2;
2) Br2;
3) N2;
4) СО;
5) В.
22. Как изменяется энтропия при изменении агрегатного состояния в ряду кристалл--жидкость—газ?
1) возрастает;
2) уменьшается;
3) не изменяется;
4) сначала возрастает, а потом уменьшается;
5) сначала уменьшается, а потом возрастает.
Кинетика химических реакций
1. Что такое скорость химической реакции?
1) изменение концентрации реагирующих веществ в единицу времени
2) число молекул, принимающих участие в элементарном акте химической реакции
3) число молекул субстрата, превращающихся под действием одной молекулы фермента
4) сумма показателей степеней в кинетическом уравнении реакции
5) изменение концентрации катализатора в единицу времени
2. Какое уравнение выражает зависимость скорости прямой реакции 2NO + O2 = 2NO2 от концентрации реагентов?
1) w = [NO]2 + [O2]
2) w = 2[NO][O2]
3) w = 2[NO2]2
4) w = k[NO][O2]
5) w = k[NO]2[O2]
3. Какое уравнение выражает зависимость скорости обратной реакции 2NO + O2 = 2NO2 от концентрации реагентов?
1) w = [NO2]2
2) w = 2[NO2]
3) w = k[NO2]2
4) w = k[NO][O2]
5) w = k[NO]2[O2]
4. Какое уравнение соответствует закону действующих масс для прямой реакции A + B + B ® AB2?
1) w = k[B][B]
2) w = k[A][B]
3) w = k[A][B]2
4) w = k[AB2]
5) w = k[A][B2]
5. Что является особенностью каталитического действия ферментов?
1) невысокая каталитическая активность
2) независимость каталитического действия от температуры
3) независимость каталитического действия от рН
4) высокая специфичность действия
5) отсутствие температурного оптимума
6. Каким уравнением выражается скорость реакции первого порядка?
1) w=k
2) w= dc/ dt
3) w=k. c
4) w=k. c2
5) w=k. ca .cb
7. В чем заключается функция ферментов в живом организме?
1) транспорт оксигенов
Увеличится в 27 раз
5) уменьшится в 27 раз
15. Какой величине пропорциональна скорость химической реакции при постоянной температуре в каждый момент времени?
1) сумме показателей степеней при концентрациях
2) произведению показателей степеней при концентрациях
3) сумме концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам
4) произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам
5) сумме концентраций продуктов реакции в степенях, равных их стехиометрическим коэффициентам
16. Чему равна константа скорости химической реакции?
1) произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам
2) числу молекул, участвующих в элементарном акте химической реакции
3) сумме показателей степеней при концентрациях
4) скорости химической реакции при концентрациях реагирующих веществ, равных единице
5) скорости химической реакции в любой момент времени
17. Как количественно выражается влияние концентрации реагирующих веществ на скорость химической реакции?
1) правилом Вант-Гоффа
2) законом действующих масс
3) уравнением Аррениуса
4) уравнением Михаэлиса-Ментен
5) уравнением Гендерсона-Гассельбаха
18. Как количественно может быть описана зависимость константы скорости химической реакции от температуры?
1) правилом Панета-Фаянса
2) законом действующих масс
3) уравнением Аррениуса
4) уравнением Михаэлиса-Ментен
5) уравнением Гендерсона-Гассельбаха
17. Какое утверждение, характеризующее ферментативную реакцию, является неверным?
1) ферменты проявляют каталитическую активность в узком интервале температур;
2) каталитическая активность ферментов зависит от кислотности или рН среды;
3) ферменты обладают высокой специфичностью и ускоряют только определенные биохимические реакции;
4) ферменты повышают энергию активации ;
5) фермент образует промежуточное соединение с субстратом
18. Какая из перечисленных реакций является гомогенной?
1) C(т) + O2(г) ® CO2(г)
2) 2NO(г) + Cl2(г) ® 2NOCl(г)
3) C(т) + H2(г) ® CH4(г)
4) FeO(т) + H2(г) ® Fe(т) + H2O(ж)
5) C(т) + H2O(ж) ® H2(г) + CO(г)
19. Какая из перечисленных реакций является гетерогенной?
1) C(т) + CO2(г) ® 2CO(г)
2) CO(г) + H2O(г) ® CO2(г) + H2(г)
3) 2SO2(г) + O2(г) ® 2SO3(г)
4) H2S(г) + Cl2(г) ® 2HCl(г) + S(т)
5) SO2(г) + 2H2S(г) ® 3S(т) + 2H2O(ж)
Поверхностные явления
1. По какой формуле рассчитывают величину поверхностной активности?
1) 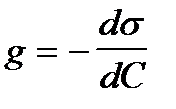 ++++
++++
2) 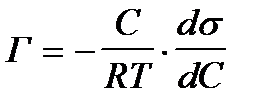
3) 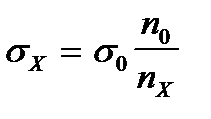
4) Г = Г¥ . C /(K + C)
5) 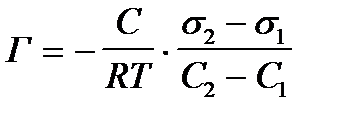
2. По какой формуле рассчитывают величину адсорбции растворенного вещества на подвижной границе раздела фаз?
1) 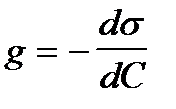
2) 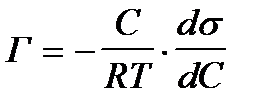 +++++++++
+++++++++
3) 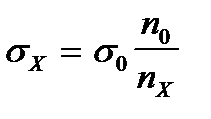
4) 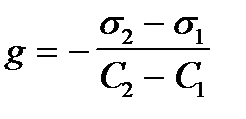
5) Г = Г¥ . C /(K + C)
3. Как можно охарактеризовать состояние адсорбционного равновесия?
1) происходит только процесс адсорбции
2) происходит только процесс десорбции
3) скорость адсорбции больше, чем скорость десорбции
4) скорость адсорбции меньше, чем скорость десорбции
5) скорость адсорбции равна скорости десорбции
4. Как называется состояние системы, при котором скорость адсорбции равна скорости десорбции?
1) положительная адсорбция
2) отрицательная адсорбция
3) удельная адсорбция
4) капиллярная конденсация
5) адсорбционное равновесие
5. Что может быть использовано для регенерации катионитов?
1) нагревание
2) замораживание
3) обработка раствором щелочи
4) обработка раствором хлорида натрия (Na)
5) обработка раствором сильной кислоты (H)
6. Какой метод может быть использован с целью предотвращения свертываемости крови при ее консервировании для удаления ионов Са2+?
1) диализ
2) электрофорез
3) хроматография
4) молекулярная адсорбция
5) ионообменная адсорбция
7. Какое вещество обладает поверхностной активностью?
1) С12Н22О11
2) HCl
3) Н2SO4 Наши рекомендации
