Степень и константа гидролиза солей, образованных сильным основанием и слабой кислотой
Кг = Kв/Кк
h = 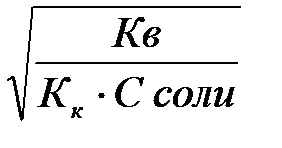
Степень и константа гидролиза солей, образованных слабым основанием и сильной кислотой
Кг = 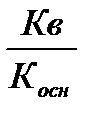
h= 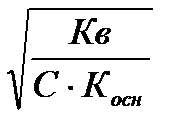
Степень и константа гидролиза солей, образованных слабым основанием и слабой кислотой. Факторы, усиливающие гидролиз и подавляющие его.
h= 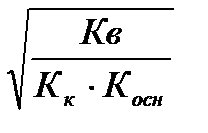
K г= 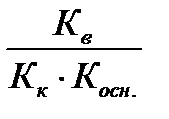
Гидролиз усиливается:
С уменьшением концентрации растворов, при нагревании, при введении в раствор кислот и оснований, смещающих равновесие
Координационная теория комплексных соединений Вернера. Комплексообразователь, лиганды внутренняя сфера, координационные числа.
Соединениями первого порядка наз.соединения типа в которых элемент проявляет свою обычную максимальную валентность. Соединениями высшего порядка, валентно-ненасыщенными, называются соединения, которые получаются при взаимодействии соединений первого порядка друг с другом.
Основу координационной теории Вернера составляют следующие положения:
1.Центральное место в комплексных соединениях занимает комплексообразователь - обычно положительно заряженный ион (чаще всего металл)
2.Вокруг комплексообразователя расположены или координированы лиганды (старое название адденды), т.е. ионы противоположного знака или нейтральные молекулы.
3.Комплексообразователь и лиганды образуют внутреннюю сферукомплексного соединения.
4.Ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферукомплексных соединений.
5.число лигандов располагающихся вокруг комплексообразователя назыв, комплексным числом
6,заряд комплексного иона численно равен суммарному заряду и определяется как алгебраическая сумма зарядов комплексообразователя и лигандов
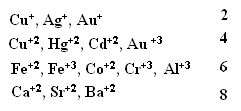
Классификация комплексных соединений.
Классификация их основывается на различных принципах.
По принадлежности к определенному классу соединений
a) Комплексные кислоты
Н[AuCl4] - хлористозолотая кислота
б) Комплексные основания
[Ag (NH3)2]OH - гидроксид диамминосеребра
в) комплексные соли
K2[PtCl4] – хлорплатинит калия
По природе лигандов
а) аквокомплексы -лигандами являются молекулы воды.
[Co(H2O)6]SO4; [Cu(H2O)4](NO3)2
б ) аммиакаты -лигандами являются молекулы аммиака
[Ag(NH3)2]Cl; [Cu(NH3)4]SO4; [Co(NH3)6]Cl2
в) гидроксокомплексы- соединения с ОН --группами в виде лигандов.
K3[Al(OH)6]; Nа 2[Zn(OH)4]
г) ацидокомплексы- содержат в качестве лигандов анионы различных кислот.
По знаку заряда комплекса
а) Комплексные катионы
[Co(NH3)6]2+Cl2; [Zn(NH3)4]2+Cl2
б) Комплексные анионы
K2[HgI4]2-; K3Fe[CN)6]3-
в) нейтральные комплексы - не имеют внешней сферы.
[Fe(CO)5]; [Ni(CO)4]; [Co(NH3)3Cl3]
Более сложны бикомплексы - содержат комплексный катион и комплексный анион:
[Co (NH3)6] [Fe (CN) 6]
Особую группу составляют сверхкомплексы, в которых число лигандов превышает координационное число комплексообразователя:
CuSO4 · 5H2O FeSO4 · 7H2O
Дентантность(координационная емкость) лиганда - это число координационных мест, которое может занимать данный лиганд. Дентантность определяется числом донорных атомов, входящих в его состав. Лиганды, содержащие 2 и более донорных атомов называют полидентантными.Число монодентантных лигандов в координационной сфере равно координационному числу комплексообразователя.Многие комплексные соединения, содержащие полидентантные лиганды, являются хелатами. Лиганды захватывают комплексообразователь подобно клешне рака (греч. Chele – клешня).
Лиганд присоединяется к комплексообразователю одновременно двумя типами связей- ионной и ковалентной, возникшей по донорно- акцепторному механизму (стрелка от донора к акцептору). Комплексообразователь как бы втянут внутрь лиганда, охвачен связями наподобие клешни рака, отсюда и название (хелат).
Пример хелата - это двунатриевая соль этилендиаминтетрауксусной кислоты, известная под названием трилона Б (или комплексон III)
