Хар-ка, хим. Состав и биолог. Роль белков
Белки́ — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс. Молекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, модификации происходят уже после синтеза белка на рибосоме). Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10130 вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками, хотя это деление весьма условно.Уровни структуры белкаКроме последовательности аминокислот полипептида (первичной структуры), крайне важна трёхмерная структура белка, которая формируется в процессе фолдинга (от англ. folding), «сворачивание»). Трёхмерная структура формируется в результате взаимодействия структур более низких уровней. Выделяют четыре уровня структуры белка:Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, важных для функции белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка. Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями. Третичная структура— пространственное строение полипептидной цепи; взаимное расположение элементов вторичной структуры, стабилизированное различными типами взаимодействий. В стабилизации третичной структуры принимают участие: ковалентные связи (между двумя остатками цистеина — дисульфидные мостики); ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
водородные связи; гидрофильно-гидрофобные взаимодействия. Четверичная структура— взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру (можно считать её и молекулой, если между разными полипептидными цепями, как это нередко бывает, образуются дисульфидные мостики). В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной.
Надмолекулярные белковые комплексы могут состоять из десятков молекул, многие из них сравнимы по размеру с рибосомами и в последние годы часто описываются как органоиды (см., напр., протеасома). Нередко в их состав входят молекулы РНК .
23..Классификация и сво-ва белков. Простые и слож. Белки:Простые белки состоят только из аминокислот среди которых есть растворимые в воде( гистоны, альбумины,, фибриноген) и нерастворимые (глобулимы, миозин, коллаген, осеин, креатин). Слож. Состоят из белковой и небелковой частей. Небелковая часть может быть представлена углеводами, нуклеиновыми кис-ми, липидами, фосфорной кис-той, окрашенным (хромо-) вещ-ми.Свой-ва белков.Основными физико-химическими свой-ми белков явл: Молекулярная масса, растворимость в воде, способность образовывать гели, денатурация, амфотерность, буферное дей-е и др. 1.Молекулярная масса белков колеблется от 6000 до нескольких миллионов дальтон. 2.Расстворимость большинства белков воде осуществляется благодаря способности связывать воду. 3. Способность образовывать гели или сгустки имеет большое физиологическое значение, поскольку придает им высокую упругость и эластичность. Гели- структур. Объединение белков. 4. Коогуляция-укрупнение частиц в коллоидных системах, которое может сопровождаться образов. Коагулянта(плотный сгусток). 5. Денатурация- это нарушение нативной структуры белков под воздействием различных факторов, приводящие к потеере его биолог. Актив. 6. Амфотерные свой-ва белков проявляются благодаря наличию свободных –NH2 и –COOH групп. 7. Буферное дей-е белков поддержание в тканях организма постоянства PH.
24..Строение, классификация и свойства аминокислот:Аминокислоты- производ.органических (карбоновых) кислот, содерж. Одну или нескольких аминогрупп(-NH2).Все аминокислоты различаются хим. Составом и строением бококвой углеродной цепи либо радикалом.Классификация:Делятся на ациклические , имеющие незамкнутый, и циклический, имеющие замкнутый углеродный радикал. В зависимости от кол-ва функц. Групп(-NH2 и –COOH) ациклические аминокислоты делятся на моноаминомонокарбоновые, моноаминодикарбоновые, диаминокарбоновые, и диаминомонокарбоновые кис-лы. Отдельные ациклические аминокислоты могут содержать оксигруппу и сульфгидрильную группу. Они назыв. Оксикислотами (серин, терозин) или серосодержащие аминокислотами(цистеин, цистин, метионин). Циклические аминокислоты делятся на гомоциклические и гетероциклические. Гомоциклические аминокис. Имеют в цикле только атомы углерода. В гетероциклических аминок-ах в цикле присутствуеют и др. хим. Элементы, наприм. Азот( пролин, гистидин, триптофан).
Сво-ва аминок: Физические свойства. Аминокислоты – твердые кристаллические вещества с высокой т.пл., при плавлении разлагаются. Хорошо растворимы в воде, водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые
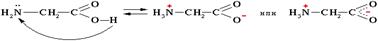
Химические свойства. Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т.е. являются амфотерными соединениями. Подобно аминам, они реагируют с кислотами с образованием солей аммония:
H2N–CH2–COOH + HCl ® Cl- [H3N–CH2–COOH]+
25.Структура белковой молекулы, виды связей.Первичная- полипептидная цепочка, состоящая из аминокислот, соед. Между собой ковалентной пептидной связью. 2. Вторичная- полипептидную цепочку свернутую в L- спираль, и структурную удерживается в пространстве нековалентными водородными связями. 3. Третичная- L- спираль, укомплектованная в пространстве.4.- Четвертичная мультимолекулы состоящие из мономерных звеньев.Связи. Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой. Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F.
26. .Баланс азотистый-- соотношение между количеством азота, которое потребляется организмом, и тем, которое выводится из него. Различают 3 вида азотистого баланса: Положительный – количество выводимого из организма азота меньше количества азота, вводимого с пищей. Азот остается в организме и расходуется на синтез белков. Характерен для растушего организма и во время беременности. Отрицательный – количество выделяемого азота превышает количество азота, поступающего в течение суток. Встречается при голодании, белковой недостаточности, тяжелых заболеваниях, когда происходит интенсивный распад белков тела. Отрицательный азотистый баланс наблюдается у пожилых людей. Азотистое равновесие – количество азота выводимого из организма, равно количеству получаемого с пищей азота. Характерно для здорового взрослого человека.
27.превращения белка в процессе пищивар. Белки разрушаются в процессе пищеварения, который обычно начинается с денатурации белка путём помещения его в кислотную среду и гидролиза с помощью ферментов, называемых протеазами. Некоторые аминокислоты, полученные в результате пищеварения, используются для синтеза белков организма, а остальные превращаются в глюкозу в процессе глюконеогенеза или используются в цикле Кребса. Использование белка в качестве источника энергии особенно важно в условиях голодания, когда собственные белки организма, в особенности мускулов, служат источником энергии[44]. Аминокислоты также являются важным источником азота в питании организма.
