Неконкурентное ингибирование
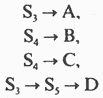
Неконкурентным называют ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата.
Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции.
Кинетические зависимости
Этот тип ингибирования характеризуется снижением Vmax ферментативной реакции и уменьшением сродства субстрата к ферменту, т.е. увеличением Кm.
Необратимое ингибирование
Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию.
К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению. При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжёлых металлов вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента.
Аллостерическая регуляция активности ферментов. Роль аллостерических ферментов в метаболизме клетки. Аллостерические эффекторы и ингибиторы. Особенности строения и функционирования аллостерических ферментов и их локализация в метаболических путях. Регуляция активности ферментов по принципу отрицательной обратной связи.
Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами. Участвующие в аллостерической регуляции эффекторы - клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют.
Роль аллостерических ферментов в метаболизме клетки.Аллостерические ферменты играют важную роль в метаболизме, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состояния клетки. Аллостерическая регуляция имеет большое значение в следующих ситуациях:
-при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений;
-при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии. Субстраты при этом расходуются на реакции запасания резервных питательных веществ;
-для координации анаболических и катаболических путей. АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты;
-для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). Таким образом, конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути.
Аллостерические эффекторы.Эффектор, вызывающий снижение (ингибирование) активности фермента, называют отрицательным эффектором, или ингибитором. Эффектор, вызьгоаюший повышение (активацию) активности ферментов, называют положительным эффектором, или активатором.
Аллостерическими эффекторами часто служат различные метаболиты. Конечные продукты метаболического пути - часто ингибиторы аллостерических ферментов, а исходные вещества - активаторы. Это так называемая гетеротропная регуляция. Такой вид аллостерической регуляции очень распространён в биологических системах.
Более редкий случай аллостерической регуляции, когда сам субстрат может выступать в качестве положительного эффектора. Такая регуляция называется гомотропной (эффектор и субстрат - одно и то же вещество). Эти ферменты имеют несколько центров связывания для субстрата, которые могут выполнять двойную функцию: каталитическую и регуляторную. Аллостерические ферменты такого типа используются в ситуации, когда субстрат накапливается в избытке и должен быстро преобразоваться в продукт.
Выявить ферменты с аллостерической регуляцией можно, изучая кинетику этих ферментов. Эти ферменты не подчиняются законам Михаэлиса-Ментен, они имеют характерную S-образную кривую зависимости скорости реакции от концентрации субстрата.
Особенности строения и функционирования аллостерических ферментов:
-обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение;
-они имеют аллостерический центр, пространственно удалённый от каталитического активного центра;
-эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах;
-аллостерические центры, так же, как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. Некоторые ферменты имеют несколько аллостерических центров, одни из которых специфичны к активаторам, другие - к ингибиторам.
-протомер, на котором находится аллостерический центр, - регуляторный протомер, в отличие от каталитического протомера, содержащего активный центр, в котором проходит химическая реакция;
-аллостерические ферменты обладают свойством кооперативности: взаимодействие аллостерического эффектора с аллостерическим центром вызывает последовательное кооперативное изменение конформации всех субъединиц, приводящее к изменению конформации активного центра и изменению сродства фермента к субстрату, что снижает или увеличивает каталитическую активность фермента;
-регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы восстанавливает исходную каталитическую активность фермента;
-аллостерические ферменты катализируют ключевые реакции данного метаболического пути.
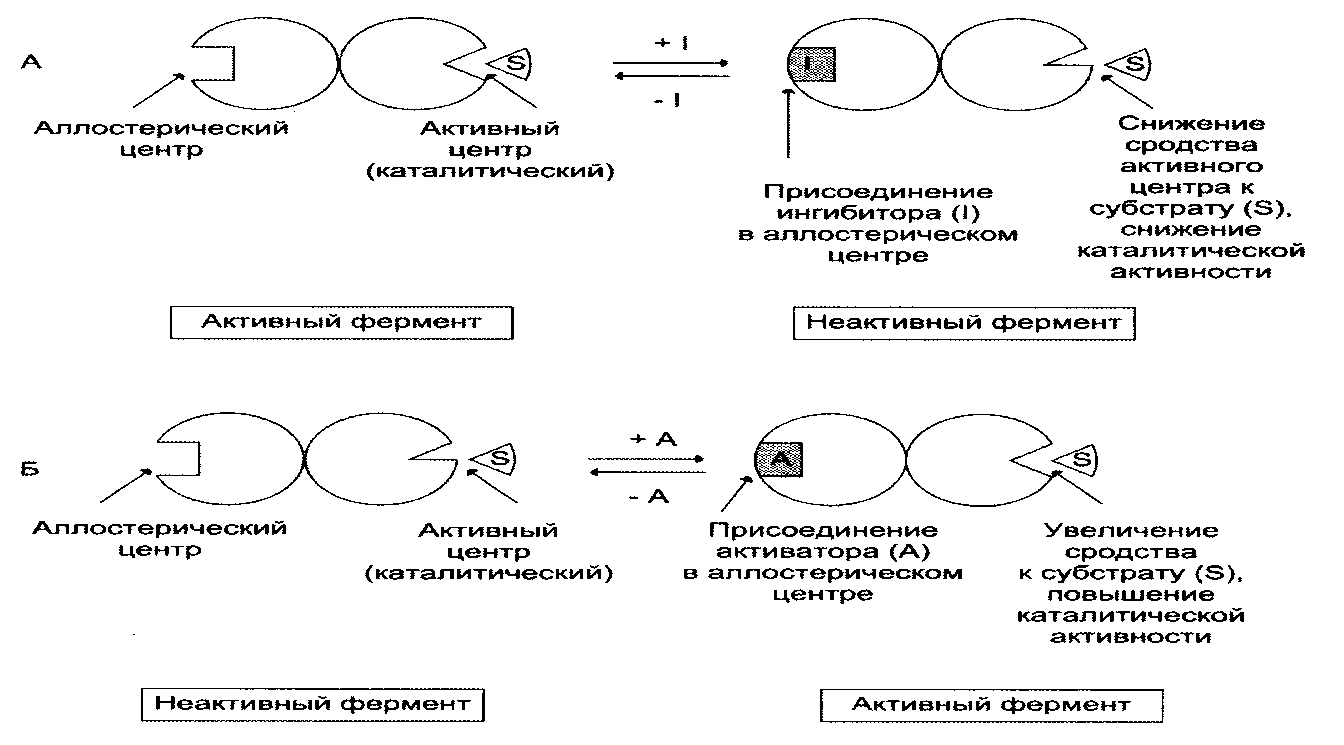
Локализация аллостерических ферментов в метаболическом пути.Скорость метаболических процессов зависит от концентрации веществ, использующихся и образующихся в данной цепи реакций. Такая регуляция представляется логичной, так как при накоплении конечного продукта он (конечный продукт) может действовать как аллостерический ингибитор фермента, катализирующего чаще всего начальный этап данного метаболического пути:
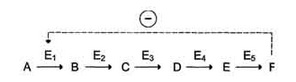
Фермент, катализирующий превращение субстрата А в продукт В, имеет аллостерический центр для отрицательного эффектора, которым служит конечный продукт метаболического пути F. Если концентрация F увеличивается (т.е. вещество F синтезируется быстрее, чем расходуется), ингибируется активность одного из начальных ферментов. Такую регуляцию называют отрицательной обратной связью, или ретроингибировани-ем. Отрицательная обратная связь - часто встречающийся механизм регуляции метаболизма в клетке.
В центральных метаболических путях исходные вещества могут быть активаторами ключевых ферментов метаболического пути. Как правило, при этом аллостерической активации подвергаются ферменты, катализирующие ключевые реакции заключительных этапов метаболического пути:
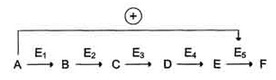
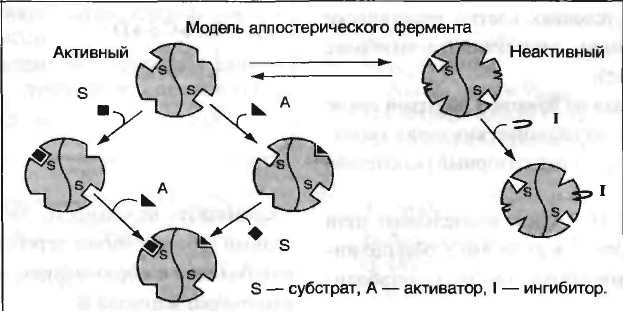
Каталитическая активность некоторых регуляторных ферментов может модулироваться низкомолекулярными аллостерическими эффекторами, обычно имеющими либо незначительное структурное сходство с субстратами или с коферментами регулируемого ими фермента, либо не имеющими его вообще. Ингибирование фермента, катализирующего одну из реакций в цепи, конечным продуктом этой цепи называют ингибированием по принципу обратной связи. В цепи реакций биосинтеза D из А, катализируемой ферментами
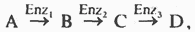
при высоких концентрациях D обычно наблюдается ингибирование превращения А в В. Это не простое «обращение» реакции, связанное с накоплением промежуточных продуктов, а следствие того, что продукт D способен связываться с ферментом выступая в качестве его ингибитора. Таким образом, D действует как отрицательный аллостерический эффектор фермента, или ингибитор, действующий по принципу обратной связи. Следовательно, ингибирование под действием D регулирует синтез D. Обычно D связывается с ингибируемым ферментом в аллостерическом центре, удаленном от каталитического центра.
В кинетическом плане ингибирование по принципу обратной связи может быть конкурентным, неконкурентным, частично конкурентным и смешанным. Ингибирование по принципу обратной связи характерно для биосинтетических путей. Очень часто ингибитор, действующий по принципу обратной связи, является последней малой молекулой перед синтезом макромолекулы (например, аминокислотой, если речь идет о синтезе белков, или нуклеотидом в синтезе нуклеиновых кислот). Регуляция по принципу обратной связи обычно происходит на первой функционально необратимой стадии, уникальной для данной цепи реакций биосинтеза.
Примерами ингибирования по принципу обратной связи в микроорганизмах могут служить ингибирование фосфорибозил: АТР—пирофосфорилазы гистидином, антранилатсинтазы—триптофаном, аспартаттранскарбамоилазы — под действием СТР. В каждом случае регуляторный фермент участвует в цепи реакций биосинтеза единственного конечного продукта - His, Тrр или СТР.
Цепь реакций биосинтеза часто бывает разветвленной— ее первые реакции дают начало синтезу сразу двух или большего числа метаболитов. На рис. 10.4 указаны вероятные участки в разветвленной цепи биосинтеза, по которым осуществляется простое ингибирование по принципу обратной связи (ингибиторами могут служить аминокислоты, пурины или пиримидины). являются предшественниками всех четырех конечных продуктов - предшественником предшественником только D. Последовательности являются линейными и могут подвергаться ингибированию конечными продуктами по принципу обратной связи.