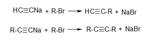
И их взаимодействие с галогеналканами и с карбонильными соединениями.
Причины повышенной кислотности атомов водорода в ацетилене (по сравнению с алканами) можно объяснить следующим образом. Атомы углерода, связанные тройной связью, находятся в состоянии sp-гибридизации. Электроны на гибридизованных sp-орбиталях С—Н-связей, у которых вклад s-состояния значительно больше, чем у хр -гибридизованных орбиталей предельных углеводородов, находятся на расстояниях, более близких к ядрам атома углерода, что равносильно повышению его электроотрицательности. Это приводит к увеличению протонной подвижности атомов водорода. Кислотность терминальных алкинов можно объяснить тем, что в образовании связи С - Н участвует sp - гибридизованная орбиталь атома углерода ( разд. С вязи С - Н в алкенах и алканах, образованные за счет sp2 - и р3 - орбиталей, менее склонны к ионизации, по крайней мере в 20 раз.
Получение ацетиленидов металлов: В отличие от многих других углеводородов ацетилен проявляет слабые кислотные свойства (рКа ≈ 25). Атомы водорода в молекуле ацетилена способны замещаться на металл. Например, ацетилен взаимодействует со щелочными и щелочноземельными металлами, а также металлоорганическими соединениями. При реакции ацетилена с аммиачными растворами солей серебра и меди (I) образуются малорастворимые ацетилениды этих металлов. В сухом состоянии ацетилениды серебра и меди неустойчивы и взрываются при нагревании. Ацетиленид серебра также чувствителен к механическим воздействиям.
Реакция ацетиленидов металлов с галогеналканами:
Ацетилени́ды — соли ацетилена и его производных, в котором один или два атома водорода замещены атомами элементов, более электроположительных, чем углерод. Углерод в ацетиленидах находится в sp-гибридизации. Синонимы: Ацетиле́нистые соедине́ния. Ацетилениды тяжёлых металловобладают значительной химической неустойчивостью, при незначительных внешних воздействиях (удар, трение) разлагаются совзрывом. Наиболее известны как инициирующиевзрывчатые вещества(ВВ) ацетиленидысеребраAg2C2 и медиCu2С2. Также следует отметить сильнейшие взрывчатые способности ацетиленида ртути и диацетиленистых производных серебра, ртути и меди. Очень сильными взрывчатыми свойствами обладает ацетиленид золота.
Ацетилениды, как соли очень слабой кислоты — ацетилена (рКа = 25), атомы водорода в молекуле ацетилена способны замещаться на металл, так же могут быть получены при взаимодействии ацетилена с щелочными и щёлочноземельными металлами (при нагревании, легче — в жидком аммиаке) или металлоорганическими соединениями. В процессе реакции происходит замещение водорода в ацетилене металлами. При взаимодействии с магнийорганическими соединениями ацетилен легко образует магнийгалогенопроизводные (реактивы Иоцича). Двузамещённые ацетилениды Cu2С2 и Ag2C2 образуются при действии на ацетилен аммиачных растворов соответствующих солей меди(I) и серебра.
При реакции ацетилена с аммиачными растворами солей серебра и меди (I) образуются малорастворимые ацетилениды этих металлов. В сухом состоянии ацетилениды серебра и меди неустойчивы и взрываются при нагревании. Ацетиленид серебра также чувствителен к механическим воздействиям.
29. Димеризация, тримеризация ацетилена. Полиацетилен. 1.Под воздействием комплексных солей меди происходит димеризация и линейная тримеризация ацетилена: HCºCH ––kat.HCºCH® CH2=CH–CºCH ––kat.HCºCH® CH2=CH–CºC–CH=CH2
2. При нагревании ацетилена в присутствии активированного угля (реакция Зелинского) осуществляется циклическая тримеризация с образованием бензола:

Полиацетилен[—CH=CH-]n или (CH)n, полимер ацетилена. Твердый реактопласт; в зависимости от метода получения - черный порошок, сероватый пористый материал, серебристые или золотистые пленки; плотн. 0,04-1,1 г/см , степень кристалличности 0-95%. Известны цис- и транс-формы полиацетилена; цис-форма при нагр. до 100-1500C переходит в транс-форму. Полиацетилен не раств. ни в одном из известных орг. р-рителей.
Электрофиз. и хим. св-ва зависят от метода получения и морфологии полиацетилена. Наиб. подробно изучены пленки. Последние (полиацетилен цис-формы)могут вытягиваться под нагрузкой 15-20 МПа (макс. удлинение в 8 раз). Прочность пленок до 38 МПа. Полиацетилен-полупроводник (уд. электропроводность 10-7 и 10-3 Ом-1·м-1 соотв. для цис- и транс-форм). Электронная структура транс-формы полиацетилена характеризуется наличием неспаренных электронов, что объясняется нарушением чередования одинарных и двойных связей в цепи. Подвижность таких дефектов определяет большинство электрофиз. характеристик полиацетилена. Допирование полиацетилена (введение небольших кол-в примесей) осуществляется при его взаимод. с сильными донорами или акцепторами электронов. В результате изменяется структура полиацетилена и его электропроводность приближается к электропроводности металла. Получают полиацетилен полимеризацией ацетилена или полимерана-логичными превращ. из насыщ. полимеров. Осн. методы: 1) пропускание ацетилена над р-ром катализатора Al(C2H5)3-Ti(OC4H9)4 в орг. р-рителе (напр., гептан, толуол) при т-рах от -800C до 1800C. Полиацетилен формируется на пов-сти р-ра в виде пленки, состоящей из фибрилл диаметром 20-50 нм; плотн. 0,4-0,7 г/см3.
30. Ароматические углеводороды. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Ароматичность, критерии ароматичности. Правило Хюккеля. Ароматические углеводороды — это органические вещества, характеризующиеся присутствием в их молекуле бензольного кольца — циклической группировки из шести атомов углерода с тремя двойными связями. К числу ароматических углеводородов принадлежат бензол ( С6Н6 ) и его производные (толуол, ксилол и др.), нафталин и его производные и др. Бензольные ароматические углеводороды — преимущественно жидкости, частью твердые тела с характерным ароматическим запахом. Применяются как растворители, а также как исходные продукты в получении пластмасс, красителей и др. Пары их в высоких концентрациях обладают наркотическим и отчасти судорожным действием.

Арены или ароматические углеводороды - это циклические соединения, образованные атомами углерода и водорода, которые имеют в своем составе ароматическую систему.
Ароматическая система - это электронная система молекулы, содержащая (в кольце), в соответствии с правилом Хюккеля, 4n+2 электронов (где n = 0, 1, 2, …).
Гомологи бензола – алкилбензолы имеют общую формулу CnH2n–6CnH2n–6.
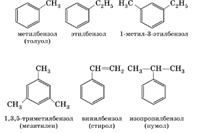
Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены различными углеводородными радикалами. Например, C6H5−CH3C6H5−CH3 - метилбензол или толуол, C6H4(CH3)2C6H4(CH3)2 - диметилбензол или ксилол, C6H5—C2H5C6H5—C2H5 - этилбензол и т.д.
Так как в бензоле все углеродные атомы равноценны, то у первого его гомолога - толуола - изомеры отсутствуют. У второго гомолога - диметилбензола - имеются три изомера, отличающиеся взаимным расположением метильных групп (заместителей).
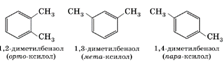
Это орто- (сокращенно о-), или 1,2-изомер, в нем заместители находятся у соседних атомов углерода. Если заместители разделены одним атомом углерода, то это мета- (сокращенно м-) или 1,3-изомер, а если они разделены двумя атомами углерода, то есть расположены напротив друг друга, то это пара- (сокращенно п-) или 1,4-изомер. В названиях заместители обозначаются буквами (о-, м-, п-) или цифрами.
В зависимости от числа ароматических колец выделяют:
одноядерныеарены (бензол и его производные),
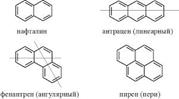
полиядерные (дифенил, дифенил метан, трифенилметан, нафталин, антрацен и т.д.)
По отношению друг к другу ароматических системы могут быть изолированнымилибоконденсированными. Конденсированные полиядерные арены являются жесткими структурами, имеющими четко фиксированное расположение в пространстве.
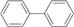
Типичным представителем многоядерных изолированных аренов является бифенил и его производные. Бензольные кольца, соединенные одинарной связью могут свободно вращаться относительно нее и принимать наиболее энергетически выгодное положение (конформацию):
Номенклатура аренов
Простейший ароматический углеводород состава C6HбC6Hб имеет тривиальное название бензол. Все остальные углеводороды этого ряда могут быть названы как замещенные производные бензола, или имеют свои тривиальные названия. При этом по традиции, установившейся в русском языке, почти все тривиальные названия гомологов бензола также имеют окончание -ол. Например: C6H5CH3C6H5CH3 — метилбензол, или толуол; C6H4(CH3)2C6H4(CH3)2 — диметилбензол, или ксилол; C6H5CH(CH3)2C6H5CH(CH3)2 — изопропилбензол, или цимол. Как исключение C6H3(CH3)3C6H3(CH3)3 или 1, 3, 5-триметилбензол имеет название мезитилен. По правилам IUPАС все названия ароматических углеводородов характеризуются окончанием -ен. Соответственно: бензен, толуен, ксилен, цимен, стирен и т. д.
На практике для образования названия дву- и более замещенных одноядерных аренов чаще используют следующие варианты:
1. В основу названия положено тривиальное название арена (толуол, стирол и т.д.), для обозначения месторасположения боковых цепей используют русские буквы (о-, м-, п-) или латинские (o-, m-, p-), что означает орто-, мета- или пара-положения бензольного кольца. Алкильные радикалы или функциональные группы называются в соответствии с номенклатурой ИЮПАК: метил-, этил-, изопропил-, амино-, гидроксо-, нитро- и т.д. Часто такие правила используются для образования названий ароматических соединений других классов - аминобензолов, фенолов и др., содержащих разные заместители.
2. Реже используются названия, в основу которых положено слово "бензол", а месторасположение радикалов-заместителей обозначается цифрами. Называя более сложные производные бензола, как и в случае алициклических соединений, из возможных порядков выбирают тот, при котором сумма цифр номеров заместителей будет наименьшей. При этом нет общепринятых правил порядка нумерации атомов бензольного ядра. По Женевской номенклатуре номер 1 присваивают тому атому заместителя, с которым непосредственно связан атом-заместитель с наименьшим атомным весом (например, при наличии в ядре —Сl и —ОН номер 1 получает атом, несущий —ОН, но при наличии —NO2NO2 и —ОН — атом, несущий —NO2; в замещенных производных гомологов бензола начало нумерации определяет простейшая боковая цепь. Для многоядерных аренов правилами номенклатуры IUPAC установлен перечень названий, положенных в основу номенклатуры конденсированных многоядерных карбоциклических систем, правила ориентации их формул и порядок нумерации атомов. В номенклатуре используются тривиальные названия (нафталин, фенантрен, антрацен) с указанием месторасположения заместителей. Например, для производных нафталина можно также использовать оба правила, описанные выше для одноядерных аренов:

Природа связей в молекуле бензолаМолекула бензола содержит систему сопряженных связей. Все шесть атомов углерода циклической молекулы бензола С6H6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода. На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвертых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные π-связи, а единая π-электронная система из шести электронов, общая для всех атомов углерода. Связи между атомами углерода в молекуле бензола совершенно одинаковые. Все связи между атомами углерода в бензоле равноценны, чем и обусловлены характерные свойства бензольного ядра. Наиболее точно это отражает структурная формула бензола в виде правильного шестиугольника с окружностью внутри. (Окружность символизирует равноценность связей между атомами углерода. ) Однако часто пользуются и формулой Кекуле с указанием двойных связей.
