В то же время следует иметь ввиду, что наличие двух и более разных функциональных групп способствует появлению специфических физических и химических свойств.
Наличие асимметрического атома углерода определяет стереохимию алифатических гидроксикислот, что подробно было рассмотрено в главе 4.
Химические свойства
В данном разделе будут обсуждены специфические реакции, характерные для гидроксикислот.
a-Гидроксикислоты. При нагревании с минеральными кислотами a-гидроксикилоты расщепляются на карбонильные соединения (альдегиды или кетоны) и муравьиную кислоту:
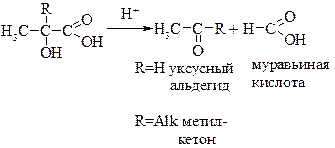
Из двух молекул a-гидроксикислоты при нагревании образуются димерные циклические сложные эфиры, которые называются лактидами (от латинского названия молочной кислота – acidum lacticum)
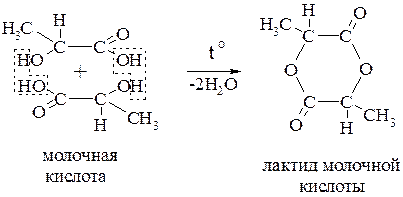
Как сложные эфиры, лактиды легко гидролизуются с образованием двух молей гидроксикислоты.
b-Гидроксикислоты. При нагревании они очень легко отщепляют воду: эта внутримолекулярная дегидратация осуществляется с участием атома водорода при a-углеродном атоме и гидроксигруппы в b-положении. В результате реакции элиминирования образуются a,b-непредельные кислоты:
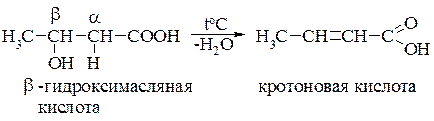
Из b-гидроксикислот при использовании специальных методов удаётся получить b-лактоны:
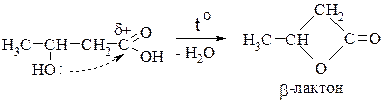
Аналогично образуются g-лактоны из соответствующих g-гидроксикислот:
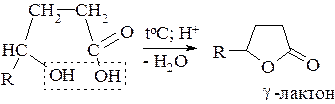
Лактоны – это внутренние сложные эфиры, в образовании которых участвует спиртовая гидроксигруппа и карбоксигруппа одной молекулы.
Отдельные представители
Гликолевая кислота (гидроксиуксусная кислота) HOCH2 – COOH является простейшей гидроксикислотой. Хорошо растворима в воде. Является компонентом свекловичного сока, недозрелых фруктов.
Молочная кислота. Впервые получена из прокисшего молока
(Шееле, 1780 г.), откуда и возникло название. Берцелиус установил (1804 г.), что в мышечной ткани содержится вещество, аналогичное молочной кислоте. Либих выделил это вещество из мышечной ткани (1832 г.) и установил, что она по составу и многим свойствам аналогична молочной кислоте брожения. Он назвал это вещество мясомолочной кислотой. Различие между двумя кислотами состояло в том, что молочная кислота брожения не обладала оптической активностью, а мясомолочная кислота вращала плоскость поляризации вправо. Позже было установлено, что сбраживанием сахарозы в присуствии Bacillus acidi laevolactici можно получить левовращающую молочную кислоту. Таким образом, в природе молочная кислота существует в виде право- и левовращающих стереоизомеров, являющихся энантиомерами, а также оптически неактивной рацемической смеси.
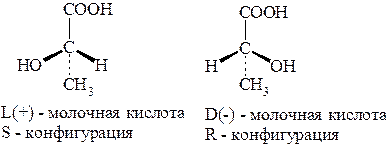
Яблочная (моногидроксиянтарная) кислота. Из названия кислоты следует, что она содержится в яблоках, откуда впервые была получена. Содержится во многих фруктах. Существует в виде пары энантиомеров, а также в виде оптически неактивного индивидуального вещества - рацемата:
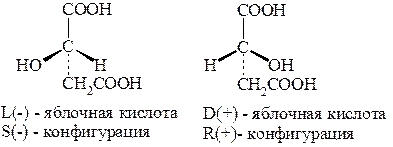
Изучая реакционную способность яблочной кислоты, П.И. Вальден (1896 г.) установил, что возможно взаимопревращение одного стереоизомера в другой. Это происходит в процессе замещенеия гидроксигруппы при асимметрическом атоме на хлор под действием PCl5: из L-яблочной кислоты образуется D-хлорянтарная кислота, которая далее под действием :ОН– переходит в D-яблочную кислоту. Такое изменение (обращение) конфигурации при асимметрическом атоме получило название вальденовского обращения, что можно представить в виде схемы:
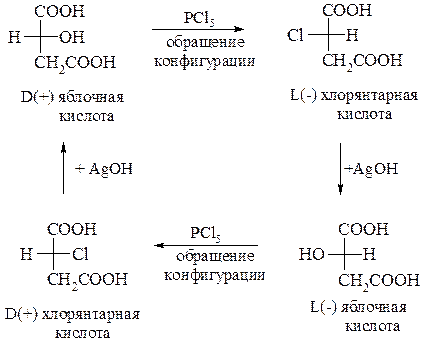
Следует обратить внимание, что обращение конфигурации при асимметрическом атоме углерода протекает по SN2 –механизму. Аналогичные вальденовскому обращению процессы могут быть осуществлены и с некоторыми другими соединениями.
Винные кислоты HOOC – CH(OH) – CH(OH) – COOH.
В молекуле дигидроксиянтарной кислоты содержатся два асимметрических углеродных атома с одинаковым набором заместителей – Н и ОН. Стереохимия винных кислот подробно рассмотрена в главе 4 (разд. 4.4). Один из изомеров был впервые выделен Шееле из осадка, образующегося при стоянии виноградного вина (винный камень). Сам винный камень представляет монокалиевую соль правовращающего изомера.
При нагревании с водой D-винная кислота постепенно переходит в оптически неактивную мезовинную кислоту и далее в виноградную кислоту, представляющую собой рацемат – (±) винную кислоту. Таким образом, известны четыре формы винных кислот D(+) винная (т. пл. 170оС; удельное вращение + 12,0); L(-) винная (т. пл. 170оС; удельное вращение – 12,0); неактивная виноградная кислота, являющаяся рацематом (т. пл. 206оС) и оптически неактивная мезовинная кислота (т. пл. 140оС). L-Винную кислоту получают путем расщепления виноградной кислоты на антиподы. В малых количествах L-винная кислота содержится в некоторых сортах виноградных вин; мезовинная в природе не обнаружена:
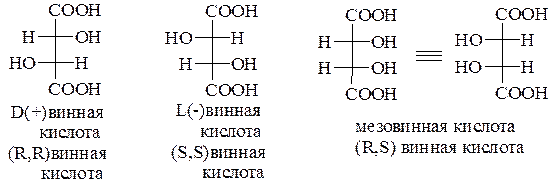
Винная кислота образует два типа солей: кислые соли – гидротартраты, средние соли – тартраты. Двойная соль – калия-натрия тартрат (сегнетова соль), будучи растворимым виц-диолом, способна реагировать с гидроксидом меди (II) в момент его образования. Благодаря этому гидроксид меди (II) не выделяется в виде осадка, а удерживается в растворе в виде комплексного соединения ярко-синего цвета.
Реактив, известный под названием реактив Фелинга(фелингова жидкость), готовится из сегнетовой соли, сульфата меди (II) и гидроксида натрия и используется в качественном и количественном анализе альдегидов и моносахаридов.
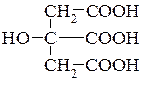 Лимонная кислота (2-гидрокси-1,2,3-пропантрикарбоновая кислота). Содержится в ягодах, плодах цитрусовых и других фруктов, листьях хлопчатника, стеблях махорки. В соке лимонов содержание лимонной кислоты достигает 7%, а в махорке (Nicotiana rustica L) - 17%, откуда и получают ее в промышленном масштабе. Является важным промежуточным продуктом обмена веществ в цикле трикарбоновых кислот. Используется в гематологии в качестве вещества, препятствующего свертыванию крови.
Лимонная кислота (2-гидрокси-1,2,3-пропантрикарбоновая кислота). Содержится в ягодах, плодах цитрусовых и других фруктов, листьях хлопчатника, стеблях махорки. В соке лимонов содержание лимонной кислоты достигает 7%, а в махорке (Nicotiana rustica L) - 17%, откуда и получают ее в промышленном масштабе. Является важным промежуточным продуктом обмена веществ в цикле трикарбоновых кислот. Используется в гематологии в качестве вещества, препятствующего свертыванию крови.
При нагревании в кислой среде лимонная кислота отщепляет муравьиную кислоту, превращаясь в ацетондикарбоновую кислоту. Последняя декарбоксилируется, что приводит к ацетону:
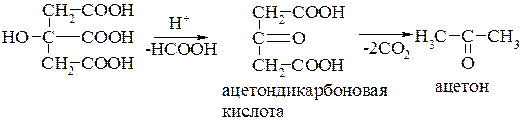
Фенолкарбоновые кислоты
Для получения фенолкарбоновых кислот используют разные способы. Кроме рассмотренных в разделе 20.1.1 способов (синтез А. Кольбе, щелочное сплавление мета-сульфобензойной кислоты), можно применять реакции, с помощью которых в ароматическое ядро вводится гидроксигруппа, например, нуклеофильное замещение диазогруппы:
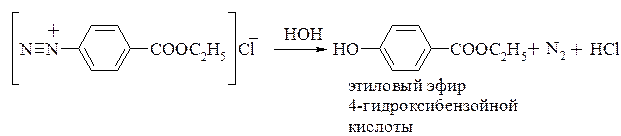
Нагреванием двухатомных фенолов с СО2 под давлением:
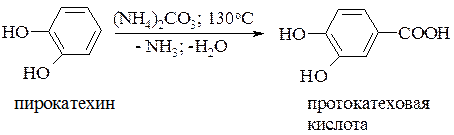
Для фенолкарбоновых кислот характерны реакции по фенольному гидроксилу, по карбоксильной группе, а также по ароматическому ядру, что подробно рассмотрено в предшествующих главах. Одним из важных представителей фенолокислот является салициловая (орто-гидроксибензойная) кислота. Она была получена в 1835 году при действии концентрированного раствора щелочи на салициловый альдегид. Сам салициловый альдегид был получен в 1831 году из лугового растения Spiraea Salicifolia (таволга иволистная). Позже, когда была открыта и описана реакция С. Канниццаро, стало понятно, что при действии щелочи на салициловый альдегид происходит реакция диспропорционирования:
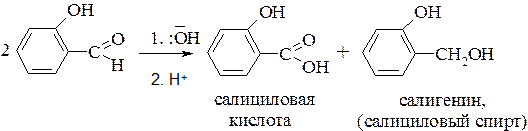
Было установлено, что салициловая кислота проявляет выраженное жаропонижающее, обезболивающее и противовоспалительное действие, но при этом, как побочный эффект, проявляется сильно выраженное раздражающее и повреждающее влияние на слизистую рта, пищевода и желудка.
Впервые ацетилирование салициловой кислоты (синтез аспирина) было осуществлено в 1853 году К. Герхардом. Спустя 40 лет химик Феликс Гофман, работавший в фирме «Bayer», вновь занялся реакцией ацетилирования салициловой кислоты в надежде получить эффективное средство для лечения ревматизма, которым страдал его отец. Так фирма «Bayer» стала обладательницей нового лекарственного препарата, который выпускает по настоящее время под торговым названием «Аспирин»:
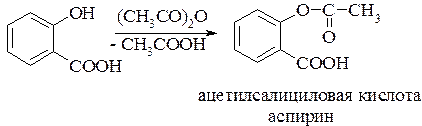
Помимо аспирина широкое применение находят сложные эфиры салициловой кислоты по карбоксильной группе – метилсалицилат и фенилсалицилат, а также амид – салициламид:
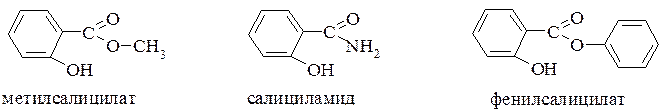
Метилсалицилат – бесцветная прозрачная жидкость с характерным запахом. Входит в состав эфирного масла ряда растений. Используется только наружно в качестве обезболивающего и противовоспалительного средства.
Фенилсалицилат (салол). Логико-структурный подход к обоснованию синтеза салола, как биологически активного соединения с заданными свойствами (жаропонижающее, противовоспалительное и антимикробное действие), по существу, является одним из первых опытов создания пролекарств.
Салициламид – более устойчив к гидролизу, поэтому из организма выводится большей частью в неизмененном виде. Применяется в тех же целях, что и аспирин.
Оксокислоты
Производные карбоновых кислот, в углеводородном радикале которых два атома водорода при одном атоме углерода замещены на оксогруппу =О, называются оксокислотами.
Если оксогруппа связана с вторичным углеродным атомом, то такие производные являются кетонокислотами (или кетокислотами), а если оксогруппа связана с первичным углеродным атомом, то – альдегидокислотами.
В названиях альдегидо- и кетокислот используют префикс оксо- для обозначения положения карбонильной группы. Для многих из них используются традиционно сложившиеся названия:
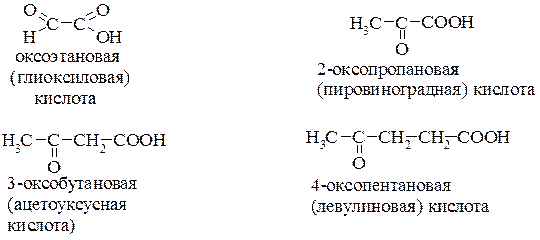
Положение оксогруппы можно обозначать и буквами a, b, g- и т.д. по аналогии с гидроксикислотами.
Получение оксокислот
Одними из общих методов получения оксокислот являются гидролиз гем-дигалогенопроизводных карбоновых кислот или окисление соответствующих гидроксикислот. Обычно доступность самих гем-дигалогенпроизводных кислот создает ограничения в применении метода гидролиза:
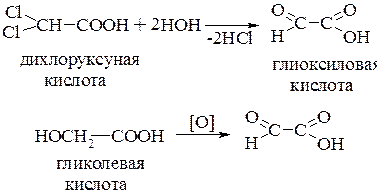
a-Оксокислоты. Помимо перечисленных выше способов получения a-оксокислот используют гидролиз оксонитрилов, которые в свою очередь могут быть получены из галогенангидридов кислот взаимодействием с цианидами:
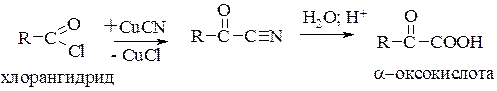
b-Оксокислоты. Общим способом получения b-оксокислот является сложноэфирная конденсация, известная под названием конденсации Кляйзена. В качестве примера приведен синтез ацетоуксусного эфира – наиболее важного из числа b-оксокилот (механизм реакции см.разд. 17.4.1):
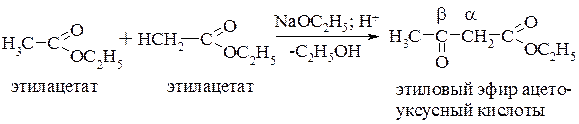
Далее полученный эфир ацетоуксусной кислоты гидролизуют концентрированной хлороводородной кислотой:
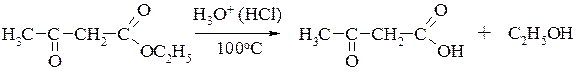
Можно осуществить также перекрёстную сложноэфирную конденсацию, однако это возможно только в том случае, когда один из реагентов не содержит a-CH-кислотного центра и, следовательно, не способен к самоконденсации:
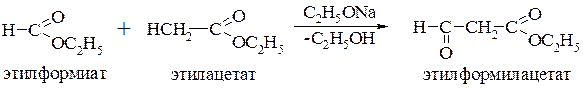
g- и d-Оксокислоты можно получить осторожным окислением соответствующих гидроксикислот, однако большинство из этого типа кислот получают специфическими реакциями.
