Рациональная система названий
За основу принимается первый типический член ряда – уксусный альдегид. Например, диметилуксусный альдегид.
Номенклатура IUPAC
За основу принимается полное название соответствующего углеводорода, к которому добавляется окончание –АЛЬ, нумерация с углерода карбоновой группы.
O
CH3-CH2-CH-CH2-C 3-метил-1-пентаналь
CH3 H
Если альдегидная группа в боковой цепи – добавляется окончание КАРБАЛЬДЕГИД, например,
CH3 CH3 CH3
СH3-C - CH-CH - CH-CH3 2,2,4,5-тетраметилгексан-3-карбальдегид
O
CH3 C
H
Гомологический ряд предельных монокетонов
| СH3-C-CH3 O | Ацетон | 2-пропанон |
| CH3-CH2-C-CH3 O | Метилэтилкетон | 2-бутанон |
| CH3-CH2-CH2-C-CH3 O | Метилпропилкетон | 4-пентанон |
| CH3-CH-C-CH3 O | Метилизопропилкетон | 3-метил-2-бутанон |
| CH3-CH2-C-CH2-CH3 O | Диэтилкетон | 3-пентанон |
Имеют два вида структурной изомерии – изомерия цепи – (1) и (2), изомерия положения (1) и (3).
Способы получения
1. Окисление и дегидрирование первичных и вторичных спиртов.
2. Сухая перегонка Ca-солей карбоновых кислот.
СH3-C-O-Ca-O-C-CH3  CaCO3 + CH3-C-CH3
CaCO3 + CH3-C-CH3
O O O
CH3-C-O-Ca-O-C-CH3
O O
H-C-O-Ca-O-C-H  2CaCO3 + 2CH3-C-H
2CaCO3 + 2CH3-C-H
O O O
3. Гидролиз гемидигалогенопроизводных (см. свойства галогенопроизводных).
4. Реакция Кучерова (см. свойства ацетиленовых углеводородов).
5. Получение альдегидов с помощью оксосинтеза.
H
СH2=CH2 + C=O + H2 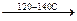 CH3-CH2-C
CH3-CH2-C
150-200 атм. O
[Co(CO)4]2
Электронное и пространственное строение карбонильных соединений
Электронное строение атома кислорода: О8 1s22s22p2x2py2pz
CH3  +
+  -
-
C=O:
H ..
Двойная связь в группе С=O состоит из 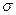 - и
- и 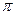 -связей. Карбонильный углерод находится в состоянии sp2-гибридизации. Все атомы, связанные с ним, расположены в одной плоскости под углом 1200. Так как атомы С и О резко отличаются по электроотрицательности,
-связей. Карбонильный углерод находится в состоянии sp2-гибридизации. Все атомы, связанные с ним, расположены в одной плоскости под углом 1200. Так как атомы С и О резко отличаются по электроотрицательности, 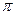 -электроны сильно смещены в сторону кислорода, и связь С=О чрезвычайно полярна.
-электроны сильно смещены в сторону кислорода, и связь С=О чрезвычайно полярна. 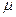 С=О=2,5Д. Двойная связь С=О отличается от двойной связи С=с способностью легко разрушаться под действием нуклеофильных реагентов (т.к. карбонильный углерод имеет положительный заряд).
С=О=2,5Д. Двойная связь С=О отличается от двойной связи С=с способностью легко разрушаться под действием нуклеофильных реагентов (т.к. карбонильный углерод имеет положительный заряд).
Индукционный эффект -передача поляризующего влияния заместителя по цепочке простой связи.
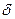 -
-
H H O
H  С
С  С
С  С
С
H H H
Физические свойства
Формальдегид – газ. Альдегиды С2-С13 – жидкости, выше – твердые вещества. Кетоны только жидкие и твердые. Температура кипения гораздо ниже, чем у соответствующих спиртов. Причина этого – отсутствие водородных связей. Низшие растворяются в воде неограниченно, с повышением молекулярного веса растворимость уменьшается. Альдегиды обладают фруктовым запахом. В инфракрасном спектре альдегидов и кетонов наблюдается характерная очень интенсивная полоса поглощения V(CO) 1700 см-1 валентных колебаний группы С=О.
Химические свойства
Альдегиды и кетоны отличаются высокой реакционной способностью, обусловленной наличием полярной группы С=О. Наиболее типичными реакциями альдегидов и кетонов являются реакции нуклеофильного присоединения.
Значительная часть реакций альдегидов и кетонов идет также за счет наличия подвижных атомов водорода в 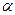 -положении к группе С=О.
-положении к группе С=О.
I. Реакции присоединения и замещения.
Протекают в основном по нуклеофильному механизму.
1) Реакция присоединения HCN начинается атакой нуклеофильных агентов ионов С=N, источником которых является катализатор (CuCN)
O - O- OH -
CH3-C + CN  CH3-C-CN
CH3-C-CN 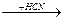 CH3-C-CN + CN
CH3-C-CN + CN
H H H
Окситрил
2) Взаимодействие с бисульфатом натрия
CH3 O CH3 O
H-C-S-ONa 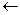 H-C + :S-ONa
H-C + :S-ONa
OH O: HO
 -
-
натриевая соль
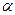 -оксиэтилсульфокислоты
-оксиэтилсульфокислоты
Это кристаллическое вещество в органических растворителях выпадает в осадок. Реакция используется для выделения альдегидов и кетонов из реакционных смесей. После отделения бисульфатные соединения разлагаются добавлением кислоты.
СH3CHOH-SO2ONa + HCl  NaCl + H2O + SO2 + CH3-C-H
NaCl + H2O + SO2 + CH3-C-H
O
3) Присоединение воды
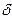 -
-
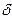 +O .. OH
+O .. OH
H-C + HOH 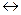 H-C-OH
H-C-OH
H OH
При попытке выделения этих веществ из водного раствора они отщепляют воду и превращаются в альдегид. Активность карбонильных соединений изменяется в следующем порядке:
O O O O
CCl3-C > H-C > R-C > R-C
H H H R
Такой ряд активности характерен и для других реакций нуклеофильного присоединения.
4) Взаимодействие со спиртами
 -
-
 +O .. OH OC2H5
+O .. OH OC2H5
СH3-C + HOC2H5  CH3-C-OC2H5
CH3-C-OC2H5  H2O + CH3-C-OC2H5
H2O + CH3-C-OC2H5
H H H
Ацетальдегид полуацеталь диэтилацеталь
(моноэтилацеталь)
В эту реакцию вступают только альдегиды.
Ацетали – нерастворимые в воде жидкости приятного фруктового запаха.
5) Взаимодействие с магнийорганическими соединениями (см. получение спиртов).
6) Взаимодействие с аммиаком и его производными.
а) взаимодействие альдегидов с аммиаком
 -
-
 +O H H
+O H H
CH3-C + NH3  CH3-C- NH2
CH3-C- NH2  H2O + CH3-C
H2O + CH3-C  полимеризация
полимеризация
H OH NH
б) взаимодействие с гидроксиламином приводит к образованию оксимов
 + .. NHOH
+ .. NHOH
CH3-C=O + NH2OH  CH3-C-OH
CH3-C-OH  H2O + CH3-C=N-OH
H2O + CH3-C=N-OH
CH3 CH3 CH3
неустойчивый
оксиамин
в) взаимодействие с гидразином и его замещенными производными приводит к образованию гидразонов
O
СH3-C + NH2-NH2  H2O + CH3-CH=N-NH2
H2O + CH3-CH=N-NH2  N2 + CH3-CH3
N2 + CH3-CH3
H
Гидразин гидразон
Реакция была использована Кижнером для восстановления альдегидов или кетонов до углеводородов, т.к. оказалось, что при нагревании в присутствии КОН гидразоны отщепляют азот.
Реакция с фенилгидразином используется как качественная на карбонильное соединение.
O
СH3-C + NH2-NH-C6H5  H2O + CH3-CH=N-NH-C6H5
H2O + CH3-CH=N-NH-C6H5
H
Фенилгидразин фенилгидразон
(оранжевого цвета)
5) взаимодействие с PCl5 (см. получение галогенопроизводных)
II. Реакции полимеризации и конденсации
1)Реакции полимеризации – дают только альдегиды
а) образование линейных полимеров
O
Формальдегид H-C при стоянии в водных растворах
H
полимеризуется с образованием линейного полимера – параформа, содержащего несколько десятков молекул полимера.
O H H H
Н-С 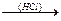 -С-O-(C-O)x-2
-С-O-(C-O)x-2  C-O-
C-O-  CH2-O-(CH2-O)x-2-CH2
CH2-O-(CH2-O)x-2-CH2
H в среде НОН Н H H OH OH
HOH параформ
х до 100
Концевые связи насыщаются за счет присоединения молекулы воды.
б) В безводных средах образуются циклические полимеры. Уксусный альдегид в присутствии серной кислоты образует циклический тример – паральдегид.
O
CH3-CH CH-CH3
3CH3-CH=O 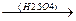 O O
O O
CH3
CH3
паральдегид
При низких температурах в эфирном растворе образуется циклический продукт соединения 4-х молекул – метальдегид. Этот кристаллический продукт применяется как твердое топливо “твердый спирт”.
2) Реакция конденсации (характерна и для альдегидов, и для кетонов)
а) альдольная конденсация протекает под действием слабых оснований
O O CH2 O O
CH3-C + CH3-C 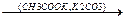 CH3-C-CH2-C
CH3-C-CH2-C 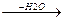 CH2-C=CH-C
CH2-C=CH-C
H H H H H
Альдоль кротоновый альдегид
б) кротоновая конденсация – продолжение альдольной. Если реакцию вести дольше, то альдоль отщепляет воду и образует непредельный альдегид или кетон. В реакцию альдольной и кротоновой конденсации могут вступать и альдегиды, и кетоны. После взаимодействия двух молекул может присоединяться третья и т.д. А.М.Бутлеров с помощью этой реакции получил сахар.
H
6СH2=O 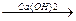 CH2-CH-CH-CH-CH-C=O
CH2-CH-CH-CH-CH-C=O
OH OH OH OH OH
Обязательным условием способности соединения вступать в реакцию альдольной и кротоновой конденсации является наличие подвижного атома Н в 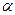 –положении к карбоновой группе.
–положении к карбоновой группе.
O
СH3-CH-C
CH3 H
вступает только в реакцию альдольной конденсации, но не дает кротоновой (нет второго подвижного атома водорода).
CH3 O
СH3-C-С триметилуксусный альдегид
CH3 H
не вступает в реакцию альдольной конденсации (нет Н в 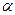 –положении).
–положении).
в) сложноэфирная конденсация (реакция Тищенко)
O O O
СH3-C + CH3-C 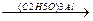 CH3-CH2-O-C-CH3
CH3-CH2-O-C-CH3
H H этилацетат
Приводит к образованию сложного эфира, т.к. идет по другому механизму. Катализатор (С2Н5О)3Al обладает электрофильными свойствами (атом Al несет положительный заряд) и способен притягиваться к неподеленной паре электронов отрицательно заряженного атома карбонильного кислорода.
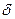 - -
- -
O 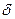 + + O-Al(OC2H5)3
+ + O-Al(OC2H5)3 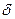 - H
- H
CH3-C + Al(OC2H5)3  CH3-C + O=C-CH3
CH3-C + O=C-CH3 
H
O-Al(OC2H5)3 O H
 CH3-C-O-C-CH3
CH3-C-O-C-CH3  CH3-C-O-C-CH3 + Al(OC2H5)3
CH3-C-O-C-CH3 + Al(OC2H5)3
H H H
ЛЕКЦИЯ 10
