ФАЗОВОЕ РАВНОВЕСИЕ В СИСТЕМЕ «НЕФТЬ — ГАЗ»
Нефть в залежи в зависимости от состава, давления и температуры может находиться в разных агрегатных состояниях. В одних случаях газовая (паровая) фаза полностью растворена в жидкой фазе, а в других — залежь имеет так называемую газовую шапку — над поверхностью жидкой нефти помещаются газы, находящиеся в фазовом равновесии с нефтью.
Фазовое равновесие каждого компонента многокомпонентной смеси характеризуется уравнением:
Y = KX,
где Y — мольная концентрация данного компонента в паровой фазе;
X — мольная концентрация этого компонента в жидкой фазе;
К — константа равновесия, т. е. отношение концентраций данного компонента в паровой и жидкой фазах смеси.
Константы равновесия определяются экспериментально, так как при большом числе компонентов расчеты их весьма сложны. Однако обычно можно ограничиться учетом основных компонентов нефти в данной залежи и, зная давление и температуру, установить расчетным путем, в каком фазовом состоянии находится смесь, а на основе этого сделать выводы об относительной высоте газовой шапки и предсказать изменение фазового состояния нефти при уменьшении давления и температуры в процессе эксплуатации залежи.
В общем виде зависимость температуры фазового перехода от давления дается уравнением Клаузиуса-Клапейрона:
dP/ dT = Q/ TΔV ,
где Т и Q — соответственно температура и теплота фазового перехода;
dP/dT — производная, которая показывает наклон кривой (на фазовой диаграмме) в координатах «давление — температура»;
ΔV — изменение объема в результате фазового перехода.
Растворимость каждого газообразного компонента пропорциональна его давлению над раствором, согласно закону Генри:
Vг = αVжP,
где Vг — объем растворенного газа, приведенный к нормальному давлению;
α — коэффициент растворимости газа, т. е. количество гaзa, растворяющегося в 1 м3 данной жидкости при давлении 105Па;
Vж — объем жидкой фазы, в которой растворен газ;
Р — давление газа над раствором.
Углеводородные газы мало отклоняются от закона Генри при сравнительно низких давлениях. При высоких давлениях наблюдается взаимное растворение газа в нефти и нефти в газе. Коэффициент растворимости для углеводородных газов обычно колеблется в пределах 0,3–2,0.
Растворение данного газообразного компонента в жидкости будет происходить до тех пор, пока парциальное давление его в газовой фазе сравняется с парциальным давлением в жидкости (закон Рауля), т. е.
P1 = P2X ,
где Р1 — парциальное давление газообразного компонента, растворенного в жидкости;
Р2 — давление насыщенных паров этого компонента при данной температуре;
X — мольная концентрация данного компонента в жидкости.
Как уже было сказано выше, при установившемся равновесии фаз парциальные давления каждого компонента в газовой и жидкой фазах равны. Константа же равновесия зависит от температуры и давления: с повышением температуры растворимость газа уменьша-ется, а следовательно, снижается мольная концентрация его в жидкой фазе.
Углеводородные газы, не содержащие углеводородов выше С4 (сухие газы), в большей степени подчиняются закону Генри, нежели газы с повышенным содержанием более тяжелых компонентов — пентана, гексана и пр. (жирные газы). Для сухих газов коэффициент растворимости в пределах обычных пластовых давлений остается постоянным, а для жирных он изменяется пропорционально давлению. При приближении к давлению перехода газа в жидкую фазу закон Генри применяться не может.
На растворимость газа влияет плотность нефти. В более тяжелых нефтях растворимость данного газа меньше, чем в легких. Это объясняется большим химическим сродством газов и легкой нефти. Жирные газы, содержащие более тяжелые углеводороды, лучше растворяются в нефти. Из всех неуглеводородных газов наибольшую растворимость в нефти имеет углекислый газ, а наименьшую — азот, углеводороды имеют растворимость среднюю между ними. Выделение из нефти растворенных в ней газов происходит в обратном порядке: при снижении давления вначале выделяется азот, затем сухие газы, жирные газы и, наконец, углекислый газ.
Помимо газов в нефти растворено некоторое количество твердых компонентов (парафинов, асфальтенов), причем эти компоненты могут выделяться из раствора при понижении температуры и давления. Особое значение имеет выпадение парафина из нефти при добыче: парафин осаждается на стенках трубопроводов, что значительно усложняет их эксплуатацию.
Парафины и асфальтены не растворимы даже в жидком пропане, поэтому можно ожидать их выделения в нефтяной залежи, если температура в ней не превышает 30°С.
При больших давлениях нефть способна растворяться в газе. Это явление носит название обратной конденсации. Оно связано с практической несжимаемостью нефти, вследствие чего ее плотность с ростом давления изменяется незначительно. Наоборот, газы сжимаются очень сильно, и при температуре выше критической и давлении, например, 5×107Па занимают объем в 500 раз меньший, чем при давлении 1×105Па. Подсчитано, что при температуре выше критической плотность газов так высока, что 1 л пропана имел бы массу 1009 г, этана — 1017 г, тогда как l л нефти средней плотности имеет массу всего около 850 г. Вполне естественно, что при высоких давлениях нефть, плотность которой при этом ниже плотности сжатых газов, растворяется в сжатом этане, пропане или их смесях. Чем больше масса 1 л газа, т. е. чем больше его плотность, тем при меньшем давлении нефть будет переходить в раствор в сжатом газе.
Нефть легко растворяется в углекислом газе, а также в метане, если к нему добавлено некоторое количество пентана или гексана. В раствор в сжатом газе может перейти вся нефть, за исключением асфальтенов, не растворимых даже в легких углеводородах. Обратная конденсация нефти в газе рассматривается как причина образования так называемых газоконденсатных залежей, а также как причина перемещения, или миграции, нефти в области с меньшим давлением, в которых происходит разделение смеси на газ и жидкую нефть.
КЛАССИФИКАЦИЯ УГЛЕВОДОРОДОВ
    | Углеводороды CXHY | ||
     Алифатические (ациклические) Алифатические (ациклические) | Циклические | ||
 | |||
| Предельные (алканы) CH4; CH3–CH–CH3 | CH3 | Ароматические (арены) CH3  ; ; 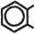 CH3 CH3 | ||
     Непредельные Непредельные | Алициклические | ||
| Алкены CH2=CH2; CH3–C=CH2 ½ СН3 | Алкины HCºCH; CH3–CH-CºCH | CH3 | Циклоалканы CH2 / \ H2C –– CH2; H2C–CH–CH3 | | H2C–CH2 | Циклоалкены 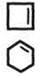 |
| Алкадиены CH2=C=CH2; CH2=C–CH=CH2 | CH3 |
