Факторы, влияющие на растворимость газов в жидкостях
Природа газа. При обычных условиях один объём, например, воды может растворить 0,02 объёма водорода, 0,05 объёмов кислорода, 400 объёмов хлористого водорода или 700 объёмов аммиака. В жидкостях лучше растворяется тот газ, который имеет более высокую температуру кипения.
Природа растворителя.Подавляющее большинство газов, молекулы которых неполярны (Н2, О2, N2 и др.), растворяется в мало полярных растворителях (например, в органических) лучше, чем в воде.
Температура.При нагревании растворимость газов в жидкостях, как правило, уменьшается. Кипячением жидкостей обычно удаётся освободить их от растворённых газов (т. е. осуществить дегазацию). С ростом температуры уменьшается растворимость в жидкости тех газов, для которых процесс растворения сопровождается выделением теплоты. Растворение газов в органических жидкостях нередко сопровождается поглощением теплоты; в подобных случаях с ростом температуры растворимость газа увеличивается.
Давление.Зависимость растворимости газов от давления выражает закон растворимости газов(Генри[38], 1803): растворимость газа в жидкости прямо пропорциональна его парциальному давлению:
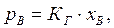
где рВ – парциальное давление газа Внад поверхностью его раствора, Па;
КГ – константа пропорциональности (константа Генри), Па;
хВ –молярная доля растворённого газа.
Понижение парциального давления газа ведёт к уменьшению его растворимости. Пример – обычная газированная вода, представляющая собой приготовленный под повышенным давлением углекислого газа его насыщенный водный раствор: при соприкосновении её с воздухом (в котором парциальное давление СО2 составляет всего 0,2 мм рт. ст.) растворённый углекислый газ начинает бурно выделяться.
Закон растворимости газов верен лишь для достаточно разбавленных растворов, при сравнительно невысоких давлениях и отсутствии химического взаимодействия молекул растворяемого газа с растворителем (или друг с другом).
Растворимость жидкостей в жидкостях
• неограниченная взаимная растворимость, или смешиваемость
(толуол – бензол, этиловый спирт – вода).
• ограниченная взаимная растворимость (вода – диэтиловый эфир,
вода – бензин);
• практически полная нерастворимость (ртуть – вода);
Если жидкости растворяются друг в друге ограниченно, то происходит образование двух жидких фаз, причём фаза с большей плотностью (насыщенный раствор бензина в воде) будет находиться в нижнем слое, а фаза с меньшей плотностью (насыщенный раствор воды в бензине) – в верхнем слое. При нагреваниирастворимость жидкостей в жидкостях чаще всего возрастает и может наступить момент (при критической температуре растворения), когда граница раздела фаз исчезнет, и образуется одна жидкая фаза (т. е. обе жидкости смеши-ваются в любых пропорциях).
Взаимное растворение жидкостей обычно не сопровождается значительным изменением объёма, и поэтому мало зависит от давления, заметно возрастая лишь при очень высоких давлениях (порядка тысяч атмосфер или 108 Па).
Растворимость твёрдых веществ в жидкостях
Существует условное деление веществ по их растворимости в конкретном растворителе при определённой температуре на практически нерастворимые (меньше 0,1 г в 100 г растворителя, или меньше 0,001 моль/л), малорастворимые (от 0,1 до 1 г в 100 г растворителя, или 0,001-0,1 моль/л) и хорошо растворимые вещества (более 1 г в 100 г растворителя, или более 0,1 моль/л) (см. приложение 2). При повышении температуры растворимость твёрдых веществ в жидкостях, как правило, увеличивается.
При растворении твёрдых веществ в воде объём системы изменяется незначительно, поэтому их растворимость практически не зависит от давления.
Идеальный раствор – раствор, образующийся как простое «физическое» смешение компонентов при отсутствии их химического взаимодействия. Образование такого раствора не сопровождается тепловым эффектом и изменением объёма (∆V = 0, ∆Н = 0). Хотя растворы не обладают свойствами идеальных, поведение многих из них достаточно удовлетворительно описывается при помощи этой модели.
6.6. ЗАКОНОМЕРНОСТИ ПОВЕДЕНИЯ РАСТВОРОВ:
ЗАКОН РАУЛЯ
Давление пара над раствором. При данной температуре давление насыщенного пара над каждой жидкостью – величина постоянная. При растворении в жидкости какого-либо нелетучего вещества давление насыщенного пара этой жидкости понижается. Таким образом, давление насыщенного пара растворителя над раствором нелетучего вещества всегда ниже, чем над чистым (индивидуальным) растворителем при той же температуре. Разность между этими величинами называют понижением давления пара растворителя над раствором(или понижением давления пара раствора). Отношение величины этого понижения к давлению насыщенного пара растворителя над чистым растворителем называется относительным понижением давления пара растворителя над раствором:
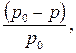
где р0 – давление насыщенного пара растворителя над чистым растворителем;
р – давление насыщенного пара растворителя над раствором.
Французский физик Рауль[39] в 1887 установил закон, связывающий понижение давления пара растворителя над разбавленными растворами неэлектролитов с концентрацией: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворённого вещества. Математическое выражение закона Рауля:
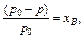
где хВ– молярная доля растворённого вещества В.
Явление понижения давления насыщенного пара растворителя над раствором вытекает из принципа Ле Шателье[40]:если на систему, находящуюся в равновесии, воздействовать извне путём изменения какого-либо параметра, то равновесие будет сдвигаться в направлении, способствующем восстановлению равновесия системы.
Представим себе равновесие между жидкостью, например водой, и её паром. Это равновесие, которому отвечает определённое давление насыщенного пара, можно выразить уравнением
(Н2О)жидк = (Н2О)пар.
Если теперь растворить в воде некоторое количество какого-либо вещества, то концентрация молекул воды в жидкости понизится и пойдёт процесс, увеличивающий её, – конденсация пара. Новое равновесие установится при более низком давлении насыщенного пара.
Замерзание и кипение растворов.Чистые (индивидуальные) вещества характеризуются строго определёнными температурами переходов из одного агрегатного состояния в другое (температура кипения tкип, температура плавления tплав или кристаллизации). При нормальном атмосферном давлении (101,325 кПа) tкип и tплав воды равны соответственно 0 и 100 °С.
Присутствие растворённого вещества повышает температуру кипения и понижает температуру замерзания растворителя, и тем сильнее, чем концентрированнее раствор. В большинстве случаёв из раствора кристаллизуется (при замерзании) или выкипает (при кипении) только растворитель, вследствие чего концентрация раствора в процессе замерзания или кипения возрастает. Это, в свою очередь, приводит к ещё большему повышению температуры кипения и снижению температуры замерзания. Таким образом, раствор кристаллизуется и кипит не при определённой температуре, а при некотором температурном интервале. Температуру начала кристаллизации и начала кипения данного раствора называют его температурой замерзания и температурой кипения.
Разность между температурами кипения раствора и чистого растворителя называют повышением температуры кипения раствора (∆tкип). Разность между температурами замерзания чистого растворителя и раствора называют понижением температуры замерзания раствора (∆tзам). Обозначая 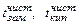 – температуры замерзания и кипения чистого растворителя, а
– температуры замерзания и кипения чистого растворителя, а 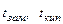 – температуры кристаллизации и кипения раствора, имеем:
– температуры кристаллизации и кипения раствора, имеем:
Всякая жидкость начинает кипеть при той температуре, при которой давление её насыщенного пара достигает величины внешнего давления. Например, вода под давлением 101,325 кПа кипит при 100 °С потому, что при этой температуре давление водяного пара как раз равно 101,325 кПа. Если же растворить в воде какое-нибудь нелетучее вещество, то давление её пара понизится. Чтобы довести давление пара полученного раствора до 101,325 кПа, нужно нагреть раствор выше 100 °С. Поэтому температура кипения раствора всегда выше температуры кипения чистого растворителя.
Кристаллизация же связана с выделением количества теплоты, равного теплоте плавления, и для чистых жидкостей протекает при постоянной температуре, причём температура кристаллизации равна температуре плавления Тпл.Последняя определяется из уравнения Клапейрона[41]-Клаузиуса[42]:
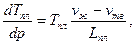
где р – давление;
vж и vтв – удельный объём жидкой и твёрдой фазы соответственно;
Lпл –удельная теплота плавления (фазового перехода).
Повышение температуры кипения и понижение температуры замерзания растворов соответствуют принципу Ле Шателье. Пусть имеется равновесие между жидкостью и твёрдой фазой, например, равновесие жидкая вода – лёд при 0 °С. Его можно выразить уравнением
(Н2О)твёрд  (Н2О)жидк.
(Н2О)жидк.
Если растворить в воде некоторое количество какого-либо вещества, то концентрация молекул воды в жидкости понизится и пойдет процесс, увеличивающий её, – плавление льда. Для установления нового равновесия необходимо понизить температуру.
Ф. Раульв 1882-1888 гг. установил, что для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорциональны концентрации раствора:
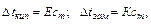
где ст – моляльная концентрация (моляльность);
Е и К – эбулиоскопическая[43] и криоскопическая[44] постоянные, зависящие только от природы растворителя , но не от природы растворённого вещества.
Для воды криоскопическая постоянная Кравна 1,85 эбулиоско-пическая постоянная Е равна 0,52. Для бензола С6Н6 К = 5,1 , Е= 2,57; для уксусной кислоты СН3СООН К = 3,9 , Е = 3,07.
На измерениях температур кипения и замерзания растворов основаны эбулиоскопический и криоскопический методы определения молекулярных масс веществ.
Закон Рауля относится к бесконечно разбавленным идеальным растворам, применение его к реальным растворам ограничено тем в большей степени, чем выше их концентрация.
6.7. ОСМОС[45]
Диффузия. Раствор представляет собой гомогенную (однородную) систему. Частицы растворённого вещества и растворителя находятся в беспорядочном тепловом движении и равномерно распределяются по всему объёму раствора. Если поместить в цилиндр концентрированный раствор какого-либо вещества, например сахара, а поверх него осторожно налить слой более разбавленного раствора сахара, то вначале сахар и вода будут распределены в объёме раствора неравномерно. Однако через некоторое время молекулы сахара и воды вновь равномерно распределятся по всему объёму жидкости. Это происходит потому, что молекулы сахара, беспорядочно двигаясь, проникают как из концентрированного раствора в разбавленный раствор, так и в обратном направлении; но при этом в течениелюбого промежутка времени из более концентрированного раствора в менее концентрированный переходит больше молекул сахара, чем из разбавленного раствора в концентрированный. Точно так же молекулы воды движутся в различных направлениях, но при этом из разбавленного раствора, более богатого водой, в концентрированный раствор переходит больше молекул воды, чем за то же время переносится в обратном направлении. Таким образом, возникает направленное перемещение сахара из концентрированного раствора в разбавленный, а воды – из разбавленного раствора в концентрированный. Каждое вещество переносится при этом туда, где его концентрация меньше. Такой самопроизвольный процесс перемещения вещества, приводящий к выравниванию его концентрации называется диффузией.
В ходе диффузии некоторая первоначальная упорядоченность в распределении веществ (высокая концентрация вещества в одной части системы и низкая – в другой) сменяется полной беспорядочностью их распределения.
Диффузию можно наблюдать, если налить в стеклянный цилиндр какой-либо окрашенный раствор, например раствор КМnО4, а сверху осторожно, чтобы не вызвать перемешивания, добавить воды. Вначале будет заметна резкая граница, но постепенно она будет размываться; через некоторое время растворённое вещество равномерно распределится по всему объёму раствора и вся жидкость примет один и тот же цвет.
В рассмотренном примере частицы растворителя и растворённого вещества диффундируют в противоположных направлениях. Такой случай называется встречной или двухсторонней диффузией. Иначе будет обстоять дело, если между двумя растворами поместить полупроницаемуюперегородку, через которую растворитель может проходить, а растворённое вещество – нет. Например, если пропитать глиняный пористый цилиндр раствором сульфата меди, приготовленного из медного купороса, а затем погрузить его в раствор гексацианоферрата(II) калия, то в порах цилиндра осядет гексацианоферрат меди:
2CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6]↓ + K2SO4.
Обработанный таким образом глиняный цилиндр обладает свойствами полупроницаемой перегородки; через его стенки могут проходить молекулы воды, но для частиц растворённого вещества они непроницаемы.
Если в такой цилиндр налить раствор какого-либо вещества, например сахара, и погрузить цилиндр в воду, то выравнивание концентраций будет происходить только вследствие перемещения молекул воды. Последние в большем числе диффундируют в раствор, чем обратно, поэтому объём раствора будет постепенно увеличиваться, а концентрация сахара уменьшаться. Такая односторонняя диффузия через полупроницаемую перегородку называется осмосом.
Роль осмоса в жизни животных и растений. Оболочки клеток легко проницаемы для воды, но почти непроницаемы для веществ, растворённых во внутриклеточной жидкости. Проникая в клетки, вода создаёт в них избыточное давление, которое слегка растягивает оболочки клеток и поддерживает их в напряжённом состоянии, поэтому такие органы растения, как травянистые стебли, листья, лепестки цветов, обладают упругостью. Если срезать растение, то вследствие испарения воды объём внутриклеточной жидкости уменьшается, оболочки клеток опадают, становятся дряблыми – растение вянет. Если начавшее вянуть растение поставить в воду, начинается осмос, оболочки клеток снова напрягаются и растение принимает прежний вид.
Осмос является одной из причин, обусловливающих поднятие воды по стеблю растения, питание клеток и многие другие явления.
Если поместить эритроциты (красные клетки крови) в водопроводную воду, они лопнут, так как концентрация солей внутри эритроцитов значительна по сравнению с водой, где их практически нет. Вследствие осмоса вода войдёт внутрь клеток и разорвёт их. Поэтому лекарственные препараты для внутривенного введения готовят не на чистой воде, а на специальном (физиологическом) солевом растворе NaCl .
Осмотическое давление (p) – внутреннее давление растворённого вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит оттемпературы и концентрации, но не зависит ни от природы растворённого вещества, ни от природы растворителя. Эту зависимость Вант Гофф[46] (1886) уподобил поведению идеального газа:
p = сRТ,
где p – осмотическое давление раствора, кПа;
с –молярная концентрация раствора (молярность), моль/л;
R – молярная газовая постоянная (универсальная), 8,314 Дж/(моль∙К);
Т – абсолютная (термодинамическая) температура раствора.
Уравнение, описывающее закон Вант Гоффа, позволяет по величине осмотического давления раствора определять молярную массу (а значит, и относительную молекулярную массу) растворённого вещества:
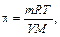
где т –масса растворённого вещества, кг;
V –объём раствора, л;
М – молярная масса, кг/моль.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
ТЕОРИЯ АРРЕНИУСА
Растворы кислот, солей и оснований обладают электропроводностью, и их поведение отклоняется от законов разбавленных растворов Рауля и Вант Гоффа.
Теория ионизации, или электролитической диссоциации(Аррениус[47], 1887): «Молекулы кислот, оснований и солей в водном растворе частичнораспадаются на самостоятельные ионы. Чем больше таких ионов, тем больше электропроводность раствора. Но по мере распада молекул на ионы растёт и общее число частиц в растворе, так как при этом из одной частицы получаются две (или более) частиц. Следовательно, закон разбавленных растворов оказывается правильным и для водных растворов кислот, оснований и солей, если учитывать как самостоятельные частицы не только молекулы, но и возникающие при их распаде ионы».
Будучи сторонником «физической» теории растворов, Аррениус не учитывал взаимодействия растворённого вещества с растворителем и считал, что молекулы распадаются на свободные ионы. Изолированное рассмотрение процесса ионизации не давало возможности для его правильного понимания.
ТЕОРИЯ КАБЛУКОВА
И.А.Каблуков[48] (1891) соединил представления С.Аррениуса и химическую теорию растворов Д.И.Менделеева: «По-нашему, вода, разлагая молекулы растворённого тела, входит с ионами в непрочные соединения, находящиеся в состоянии диссоциации; по мнению же Аррениуса, ионы свободно двигаются подобно тем отдельным атомам, которые происходят при диссоциации молекул галоидов при высокой температуре». С точки зрения Каблукова, в водных растворах содержатся не свободные, а гидратированные ионы, причём именно гидратация и является основной причиной ионизации молекул.
Положительно заряженные ионы называют катионами, отрицательно заряженные – анионами.
Процесс распада вещества на отдельные ионы. Около каждого из ионов, растворяемого в воде ионного вещества, например NаСl, отрицательный полюс диполя воды будет притягиваться к положительному иону Nа+, а положительный полюс отталкиваться и притягиваться к отрицательному иону Сl–. В результате около обоих ионов соберётся ряд притянутых ими диполярных молекул воды. Силы притяжения между ионами ослабевают настолько, что энергия взаимодействия с молекулами воды (гидратации) оказывается достаточной для того, чтобы отделить ионы друг от друга.
В растворителях менее полярных, чем вода, ориентация диполей около ионов происходит значительно меньше. Соответственно уменьшается и ослабление сил притяжения между ионами, из-за чего энергия гидратации может оказаться недостаточной для отделения их друг от друга. Поэтому распад молекулы на ионы обычно не наблюдается в таких малополярных растворителях, как диэтиловый эфир, бензол и т. п., и лишь сравнительно слабо происходит в растворителях промежуточной полярности, например в этиловом спирте[49]. Ослабление сил притяжения между поляризованными атомами зависит от диэлектрической проницаемости (ε) растворителя, так как последняя входит в полное выражение основного закона электростатики– закона Кулона:
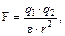
где F – сила взаимодействия зарядов q1 и q2;
r – расстояние между зарядами;
ε – диэлектрическая проницаемость растворителя.
Для воды при обычных условиях (20 0C) ε = 81, поэтому в воде силы притяжения между ионами в 81 раз меньше, чем в кристалле (где для окружающего частицы пространства ε = 1). Значения ε для этилового спирта, диэтилового эфира[50] и бензола[51] соответственно равны 26,8, 4 и 2.
Распад в воде на ионы наблюдается не только для ионных веществ, но и для веществ, молекулы которых в свободном состоянии являются полярными. Пример – HCl. Предварительная стадия распада – переход полярной структуры в ионную, происходящий под воздействием диполей воды. Притянувшиеся диполи воды к концам полярной молекулы обусловливают расхождение её полюсов, которое может закончиться тем, что молекула приобретёт ионную структуру.
У веществ с ионной и полярными связями распад на ионы идёт прежде всего по ионным связям, а затем по тем из полярных, которые ионогенны (т. е. способны достаточно легко переходить в ионные). По малополярным и неполярным ковалентным связям распад на ионы, как правило, не происходит.
