Вычисление молярных масс эквивалентов окислителей и восстановителей
При вычисления молярных масс эквивалентов окислителей и восстановителей исходят из числа электронов, которые присоединяет или отдает в данной реакции молекула вещества. Для нахождения молярной массы эквивалента окислителя (восстановителя) нужно его молярную массу разделить на число принятых (отданных) электронов в данной полуреакции.
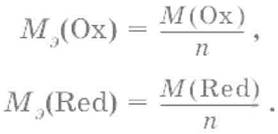
Например, в реакции окисления сульфата железа(II) перманганатом калия в кислой среде:
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O
1 | MnO4¯ + 8Н++ 5ē → Mn2++ 4H2O
5 | Fe2+– ē → Fe3+
ион MnO4¯ как окислитель принимает пять электронов, а ион Fe2+как восстановитель отдает один электрон. Поэтому для расчета молярных масс эквивалентов окислителя и восстановителя их молярные массы следует разделить на пять и на один соответственно.
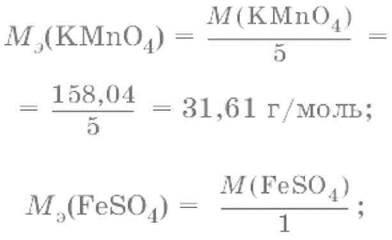
M3(Fe2+) = M(Fe2+) = 55,85 г/моль.
В реакции окисления сульфита натрия перманганатом калия в нейтральной среде:
2KMnO4 + 3Na2SO3 + Н2O → 2MnO2 + 3Na2SO4 + 2KOH
2 | MnO4¯ + 2Н2O + Зē → MnO2 + 4OH¯
3 | SO32‑+ 2OH¯ + 2ē → SO42‑+ Н2O
ион MnO4¯ принимает только три электрона, а ион восстановителя SO32‑отдает два электрона, следовательно:
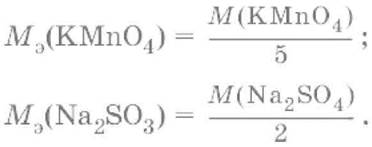
Молярные массы эквивалентов окислителей и восстановителей зависят от условий проведения реакций и определяются, исходя из соответствующих полуреакций.
Фотоколориметрия
Фотоколориметрия – оптический метод анализа, который рассматривает взаимодействие вещества с электромагнитным излучением в видимой области: длина волны (λ)380–750 нм; волновое число (v) 2,5 104– 1,5 • 104см‑1; энергия излучения (Е)1–10 эВ.
Поглощенное световое излучение количественно описывается законом Бугера–Ламберта‑Бера:
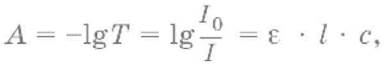
где А – поглощение вещества, или его оптическая плотность; Т – пропускание образца, т. е. отношение интенсивности света, прошедшего через образец, к интенсивности падающего света, I/I0; с – концентрация вещества (обычно моль/л); l – толщина кюветы (см); ε – молярная поглощательная способность вещества или молярный коэффициент поглощения [л/(моль см)].
Расчет молярного коэффициента поглощения проводят по формуле:
ε = А/(с Ь).
V. ФИЗИЧЕСКАЯ ХИМИЯ
Основные понятия термодинамики
Термодинамическая система – тело или группа тел, находящихся во взаимодействии, мысленно или реально обособленные от окружающей среды.
Гомогенная система – система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы).
Гетерогенная система – система, внутри которой присутствуют поверхности, разделяющие отличающиеся по свойствам части системы.
Фаза – совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделенная от других частей системы видимыми поверхностями раздела.
Изолированная система – система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – система, которая обменивается с окружающей средой энергией, но не обменивается веществом.
Открытая система – система, которая обменивается с окружающей средой и веществом, и энергией.
Параметры состояния – величины, характеризующие какое‑либо макроскопическое свойство рассматриваемой системы.
Термодинамический процесс – всякое изменение термодинамического состояния системы (изменения хотя бы одного параметра состояния).
Обратимый процесс – процесс, допускающий возможность возвращения системы в исходное состояние без того, чтобы в окружающей среде остались какие‑либо изменения.
Равновесный процесс – процесс, при котором система проходит через непрерывный ряд состояний, бесконечно близких к состоянию равновесия. Характерные особенности равновесного процесса:
1) бесконечно малая разность действующих и противодействующих сил: Fex – Fin → 0;
2) совершение системой в прямом процессе максимальной работы |W| =max;
3) бесконечно медленное течение процесса, связанное с бесконечно малой разностью действующих сил и бесконечно большим числом промежуточных состояний t → ∞.
Самопроизвольный процесс – процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве, пропорциональном произошедшему изменению состояния системы. Самопроизвольный процесс может протекать обратимоили необратимо.
Несамопроизвольный процесс – процесс, для протекания которого требуется затрата работы извне в количестве, пропорциональном производимому изменению состояния системы.
Энергия – мера способности системы совершать работу; общая качественная мера движения и взаимодействия материи. Энергия является неотъемлемым свойством материи. Различают потенциальную энергию,обусловленную положением тела в поле некоторых сил, и кинетическую энергию,обусловленную изменением положения тела в пространстве.
Внутренняя энергия системы U – сумма кинетической и потенциальной энергии всех частиц, составляющих систему. Можно также определить внутреннюю энергию системы как ее полную энергию за вычетом кинетической и потенциальной энергии системы как целого. [U] = Дж.
Теплота Q – форма передачи энергии путем неупорядоченного движения молекул, путем хаотических столкновений молекул двух соприкасающихся тел, т. е. путем теплопроводности (и одновременно путем излучения). Q >0, если система получает теплоту из окружающей среды. [Q] = Дж.
Работа W – форма передачи энергии путем упорядоченного движения частиц (макроскопических масс) под действием каких‑либо сил. W >0, если окружающая среда совершает работу над системой. [W] = Дж.
Вся работа делится на механическую работу расширения (или сжатия)и прочие виды работы (полезная работа): δW = –pdV + δW′.
Стандартное состояние твердых и жидких веществ – устойчивое состояние чистого вещества при данной температуре под давлением р =1атм.
Стандартное состоянии чистого газа – состояние газа, подчиняющееся уравнению состояния идеального газа при давлении 1 атм.
Стандартные величины – величины, определенные для веществ, находящихся в стандартном состоянии (обозначаются надстрочным индексом 0).
Первое начало термодинамики
Энергия неуничтожаема и несотворяема; она может только переходить из одной формы в другую в эквивалентных соотношениях.
Первое начало термодинамики представляет собой постулат – оно не может быть доказано логическим путем или выведено из каких‑либо более общих положений.
Первое начало термодинамики устанавливает соотношение между теплотой Q,работой Wи изменением внутренней энергии системы ΔU.
Изолированная система
Внутренняя энергия изолированной системы остается постоянной.
U =const или dU =0
Закрытая система
Изменение внутренней энергии закрытой системы совершается за счет теплоты, сообщенной системе, и/или работы, совершенной над системой.
ΔU =Q +Wили dU = δQ + δW
Открытая система
Изменение внутренней энергии открытой системы совершается за счет теплоты, сообщенной системе, и/или работы, совершенной над системой, а также за счет изменения массы системы.
ΔU =Q +W + ΔUmили dU = δQ + δW + iΣUidni
Внутренняя энергия является функцией состояния; это означает, что изменение внутренней энергии ΔU не зависит от пути перехода системы из состояния 1 в состояние 2 и равно разности величин внутренней энергии U2и U1 в этих состояниях:
ΔU =U2– U1
Для некоторого процесса:
ΔU = Σ(viUi)npoд– Σ(viUi)исх
