Важнейшие природные гомополисахариды: целлюлоза, гликоген, крахмал. Особенности строения, свойства, биологическая роль, применение.
По своему функциональному назначению гомополисахариды могут быть разделены на две группы: структурные и резервные полисахариды. Важным структурным гомополисахаридом является целлюлоза, а главными резервными –гликоген и крахмал (у животных и растений соответственно).
Крахмал (C6H10O5)n − один из самых распространенных запасных полисахаридов растений. Он накапливается в результате фотосинтеза. Крахмал представляет собой смесь двух гомогенных однородных полисахаридов: амилозы − линейного, и амилопектина − разветвленного.
При гидролизе крахмала образуются в первую очередь промежуточные продукты − декстрины, а затем дисахарид мальтоза и даже глюкоза. Крахмал находит широкое применение в медицине, фармацевтической, пищевой и др. отраслях промышленности.
Гликоген − животный крахмал, имеет более разветвленное строение, чем амилопектин крахмала. Молекулярная масса в среднем составляет от 10 млн. до 1 млрд. единиц. В наибольшем количестве находится в печени (до 10–20 %) и мышцах (до 4 %).
Целлюлоза (клетчатка) наиболее распространена в растительном мире. Имеет линейное строение, близкое к амилозе крахмала, но в качестве мономеров здесь выступают остатки β-D-глюкозы. Две линейные молекулы целлюлозы обычно располагаются параллельно друг другу, между ними возникают водородные связи − образуются как бы микрофибриллы, которые "цементируются" другими полисахаридами, пектиновыми веществами, лигнином. Так образуется клеточная стяжка растений, имеющая многослойное строение. Молекулярная масса точно не установлена, однако можно принять, что она колеблется от 300 тыс. до 10 млн. единиц.
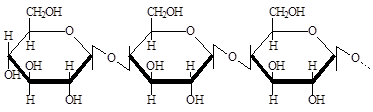
Целлюлоза
Клетчатка не переваривается в желудочно-кишечном тракте человека, т. к. там отсутствуют ферменты, способные гидролизовать целлюлозу. Есть животные (крупный рогатый скот), у которых для этого особо приспособлен желудок, состоящий из нескольких частей.
Алифатические и ароматические амины, классификация и номенклатура. Строение и химические свойства. Основный характер аминов. Получение анилина и его применение.
Ами́ны — органические соединения, являющиеся производными аммиака, в молекулекоторого один, два или три атома водорода замещены на углеводородные радикалы.
По числу NH2-групп в молекуле амины делят на моноамины, диамины, триамины и так далее.
Номенклатура
К названию органических остатков, связанных с азотом, добавляют слово «амин» при этом группы упоминают в алфавитном порядке: CH3NHC3H7 —метилпропиламин, CH3N(C6H5)2 — метилдифениламин. Для высших аминов название составляется, взяв за основу углеводород, прибавлением приставки «амино», «диамино», «триамино», указывая числовой индекс атома углерода: 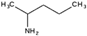 2-аминопентан
2-аминопентан
Химические свойства
Низшие амины сравнительно хорошо растворимы в воде. При этом наблюдается щелочная реакция в растворе и, как основания, амины более сильные, чем NH4OH.
При взаимодействии с кислотами образуются соли аминов:
R2NH + HCl ® [R2NH2]Cl,
Щелочи разлагают эти соли, давая аммиак или исходные амины:
[R2NH2]Cl + KOH ® R2NH + KCl + H2O,
Анилин - гораздо более слабое основание, чем алифатические амины. Это объясняется тем, что электронная пара атома азота, которая обусловливает основные свойства аминов, частично смещается в бензольное кольцо.
Анилин реагирует с сильными кислотами, образуя соли фениламмония С6Н5NН2 + HCl → С6Н5NН3Сl.
Получение
В промышленности анилин получают в две стадии. На первой стадии бензол нитруется смесью концентрированной азотной и серной кислот при температуре 50—60 °C, в результате образуется нитробензол. На втором этапе нитробензол гидрируют при температуре 200—300 °C в присутствии катализаторов: 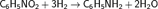
Впервые восстановление нитробензола было произведено с помощью железа:

Другим способом получение анилина является восстановление нитросоединений — реакция Зинина: 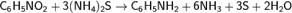
Он применяется в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств.
