Предельные углеводороды. Особенности строения, номенклатура и изомерия, химические свойства. Радикальный механизм реакций замещения у алканов.
Алканы – органич соединения, состоящие из атомов С и Н, которые связаны между собой одиночными σ-связями. Общая формула СnH2n+2.
У С на внешней оболочке имеются два неспаренных электрона, следовательно углерод должен быть двухвалентен. Но углерод в органических соединениях четырехвалентен. При образовании ковалентной связи атом углерода переходит в возбужденное состояние, при котором электронная пара на 2s- орбитали разобщается и один электрон занимает вакантную p-орбиталь.
В результате не два, а 4 неспаренных электрона.при "смешении" 4 орбиталей возбужденного атома углерода (1 2s- и 3 2p- орбиталей) образуются 4 равноценные sp3- гибридные орбитали. Они имеют форму гантели, одна из половин которой значительно больше другой. Изомерия – структурная (цепи).
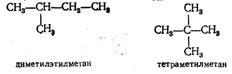
Номенклатура.
По номенклатуре ИЮПАК названия предельных углеводородов (алканов) характеризуются суффиксом -ан. метан — СH4 ;этан — CH3-CH3; пропан — CH3-CH2-CH3; бутан — CH3-(CH2)2-CH3 и т.д.
Названия углеводородов с разветвленными цепями строятся следующим образом
1. За основу названия данного соединения берут название углеводорода, соответствующее числу углеродных атомов главной цепи:
главной цепью углеродных атомов считают самую длинную;
если в углеводороде можно выделить две или несколько одинаково длинных цепей, то за главную выбирают ту из них, которая имеет наибольшее число разветвлений.
2. После установления главной цепи необходимо пронумеровать углеродные атомы. Нумерацию начинают с того конца цепи, к которому ближе примыкает любой из алкилов. Если разные алкилы находятся на равном удалении от обоих концов цепи, то нумерацию начинают с того конца, к которому ближе радикал с меньшим числом углеродных атомов (метил, этил, пропил и т. д.).
Если углеводород содержит несколько одинаковых радикалов, то число их обозначают греческим числительным (ди, три, тетра и т. д.) 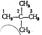 2,2-диметилпропан.
2,2-диметилпропан.
Радикалы называют, заменяя суффикс -ан в названии углеводорода на -ил: метил CH3- ;этил CH3-CH2- ; пропил CH3-CH2-CH2
Хим св-ва. Мало реактивноспособны, характерны реакции замещения и расщепления. Не свойственны реакции присоединения.
1.Горение (окисление с разрывом связей C—C и C—H):
CH4 + 2O2 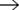 CO2 + 2H2O + Q
CO2 + 2H2O + Q
2. Замещение (с разрывом связей C—H):
а) галогенирование (только с хлором и с бромом):проходит поэтапно — за один этап замещается не более одного атома водорода:
CH4 + Cl2 → CH3Cl + HCl (хлорметан)
CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан)
CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
Если в м-ле алкана есть вторичные и третичные атомы С, то р-ция легче протекает по третичным→вторичным→первичным атомам.
б) нитрование (р-ция Коновалова): в присутсв нитрующей смеси:1чHNO3+2чH2SO4, при нагрев.
в) сульфирование- для средних и высших алканов.
Этиленовые углеводороды. Особенности строения, номенклатура, виды изомерии алкенов. Химические свойства и получение алкенов. Механизм реакций электрофильного присоединения. Качественные реакции на кратную связь.
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие однудвойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алкановзаменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Алкены, число атомов углерода в которых больше двух, (т.е. кроме этилена) имеют изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная. Например, единственным изомером пропена является циклопропан (C3H6) по межклассовой изомерии. Начиная с бутена, существуют изомеры по положению двойной связи (бутен-1 и бутен-2), по углеродному скелету (изобутилен или метилпропен) и геометрические изомеры (цис-бутен-2 и транс-бутен-2). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.
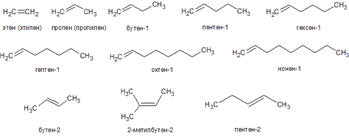
При нормальных условиях алкены с C2H4 до C4H8 — газы; с пентена C5H10 до гексадецена C17H34 включительно — жидкости, а начиная с октадецена C18H36 — твёрдые вещества. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Основным промышленным методом получения алкенов является каталитический и высокотемпературный крекинг углеводородов нефти и природного газа. Для производства низших алкенов используют также реакцию дегидратации соответствующих спиртов.
Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения.
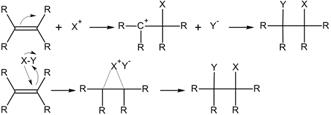
Механизм реакций электрофильного присоединения по связи углерод-углерод
Электрофильное присоединение по кратной связи обычно, двухстадийный процесс AdE2 — реакция бимолекулярного электрофильного присоединения (англ. addition electrophilic bimolecular). На первом этапе происходит атака электрофила и образование π-комплекса, который затем расщепляется, а далее образовавшийся карбкатион подвергается нуклеофильной атаке: