Предельные углеводороды (алканы). Химические и физические свойства: реакции радикального замещения. Галогенирования, нитрирование, сульфохлорирование, сульфоокисление. Понятие о цепных реакциях.
Физические свойства
В обычных условиях первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, а начиная с C18 – твердые вещества. Температуры плавления и кипения алканов их плотности увеличиваются с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями.
Химические свойства
Тривиальное (историческое) название алканов - "парафины" - означает "не имеющие сродства". Алканы химически малоактивны. Низкая реакционная способность алканов обусловлена очень малой полярностью связей С-С и С-Н в их молекулах вследствие почти одинаковой электроотрицательности атомов углерода и водорода. Предельные углеводороды в обычных условиях не взаимодействуют ни с концентрированными кислотами, ни со щелочами, ни даже с таким активным реагентом как перманганат калия.
Для них свойственны реакции замещения водородных атомов и расщепления.
Реакции радикального замещения
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть.
Галогенирование — это одна из реакций замещения. CH4 + Cl2 → CH3Cl (хлорметан) + HCl
Нитрование:RH + HNO3 → RNO2 + H2O.
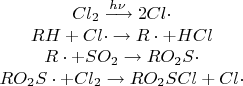 Сульфохлорирование (реакция Рида):
Сульфохлорирование (реакция Рида):
При облучении УФ-излучениемалканы реагируют со смесью SO2 и Cl2
11. Предельные углеводороды ряда метана. Химические свойства: крекинг, дегидрирование, изомеризация, дегидроциклизация. Реакция окисления, частичное окисление, образование и распад гидропероксидов (автоокисление). Применение алканов.
| Формула | Название |
| CH4 | метан |
| C2H6 | этан |
| C3H8 | пропан |
| C4H10 | бутан |
| C4H10 | изобутан |
| C5H12 | пентан |
| C5H12 | изопентан |
| C5H12 | неопентан |
| C6H14 | гексан |
| C7H16 | гептан |
| C10H22 | декан |
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп - СН2-.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами.
Крекинг. При высокой температуре в присутствии катализаторов предельные углеводороды подвергаются расщеплению, которое называется крекингом. При крекинге происходит гомолитический разрыв углерод-углеродных связей с образованием насыщенных и ненасыщенных углеводородов с более короткими цепями.
CH3–CH2–CH2–CH3(бутан) ––400°C> CH3–CH3(этан) + CH2=CH2(этилен)
Окисление. В обычных условиях алканыустойчивы к действию кислорода и окислителей. При поджигании на воздухе алканы горят, превращаясь в двуокись углерода и воду и выделяя большое количество тепла.
В общем виде реакцию горения алканов можно записать следующим образом:
СnН2n+2 +(1,5n+0,5)O2 → nCO2 + (n+1)H2O.
Повышение температуры процесса ведет к более глубоким распадам углеводородов и, в частности, к дегидрированию, т.е. к отщеплению водорода. Так, метан при 1500ºС приводит к ацетилену.
2CH4 ––1500°C> H–C=C–H(ацетилен) + 3H2
Изомеризация.
Алканы нормального строения под влиянием катализаторов и нагревании способны превращаться в разветвленные без изменения состава молекул – изомеризация.
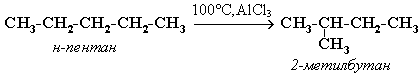
Применение
Первый в ряду алканов – метан – является основным компонентом природных и попутных газов и широко используется в качестве промышленного и бытового газа.
Средние члены гомологического ряда применяются как растворители и моторные топлива.
Жидкие углеводороды используются как горючее (они входят в состав бензина и керосина). Алканы широко используются в органическом синтезе.
