Водород. Строение атома, физические и химические свойства, получение и применение водорода.
ВОДОРОД, H, химический элемент с атомным номером 1, атомная масса 1,00794.
Так как в ядре атома водорода содержится только 1 протон (меньше в ядре атома элемента протонов быть не может), то иногда говорят, что водород образует естественную нижнюю границу периодической системы элементов Д. И. Менделеева Его относят и к 1-й группе (группе IА щелочных металлов), и к 7-й группе (группе VIIA галогенов).
Конфигурация единственного электронного слоя нейтрального невозбужденного атома водорода 1s1. В соединениях проявляет степени окисления +1 и, реже, –1 (валентность I). Радиус нейтрального атома водорода 0,0529 нм. Энергия ионизации атома 13,595 эВ, сродство к электрону 0,75 эВ. По шкале Полинга электроотрицательность водорода 2,20. Водород принадлежит к числу неметаллов.
В свободном виде — легкий горючий газ без цвета, запаха и вкуса.
Физические и химические свойства: при обычных условиях водород — легкий (плотность при нормальных условиях 0,0899 кг/м3) бесцветный газ. Температура плавления –259,15°C, температура кипения –252,7°C. Жидкий водород (при температуре кипения) обладает плотностью 70,8 кг/м3 и является самой легкой жидкостью. Стандартный электродный потенциал Н2/Н– в водном растворе принимают равным 0. Водород плохо растворим в воде: при 0°C растворимость составляет менее 0,02 см3/мл, но хорошо растворим в некоторых металлах (губчатое железо и других), особенно хорошо — в металлическом палладии (около 850 объемов водорода в 1 объеме металла). Теплота сгорания водорода равна 143,06 МДж/кг.
Так как ядро каждого атома Н, входящего в состав молекулы, имеет свой спин, то молекулярный водород может находиться в двух формах: в форме ортоводорода (о-Н2) (оба спина имеют одинаковую ориентацию) и в форме параводорода (п-Н2) (спины имеют разную ориентацию). При обычных условиях нормальный водород представляет собой смесь 75% о-Н2 и 25% п-Н2.
Без нагревания, при простом смешивании водород реагирует (с взрывом) только с газообразным фтором (F):
H2 + F2 = 2HF + Q.
Химические свойства Водорода. В большинстве соединений Водород проявляет валентность (точнее, степень окисления) +1, подобно натрию и другим щелочным металлам; обычно он и рассматривается как аналог этих металлов, возглавляющий I группу системы Менделеева
Атомарный Водород обладает повышенной химические активностью по сравнению с молекулярным. С кислородом Водород образует воду:
Н2 + 1/2О2 = Н2О
Водород используется для восстановления многих металлов, так как отнимает кислород у их оксидов:
CuO + H2 = Cu + H2O,
Fe3O4 + 4H2 = 3Fe + 4Н2О, и т. д.
С галогенами Водород образует галогеноводороды, например:
Н2 + Cl2 = 2НСl.
С азотом Водород взаимодействует с образованием аммиака:
ЗН2 + N2 = 2NН3
При нагревании Водород энергично реагирует с серой:
Н2 + S = H2S (сероводород),
Водород непосредственно реагирует с некоторыми металлами (щелочными, щелочноземельными и другими), образуя гидриды:
Н2 + 2Li = 2LiH.
Важнейшими способами производства Водорода из природного газа являются каталитическое взаимодействие углеводородов, главным образом метана, с водяным паром (конверсия):
СН4 + H2О = СО + ЗН2,
и неполное окисление углеводородов кислородом:
СН4 + 1/2О2 = СО + 2Н2
Образующийся оксид углерода (II) также подвергается конверсии:
СО + Н2О = СО2 + Н2.
Водород, добываемый из природного газа, самый дешевый.
В лабораториях Водород получают электролизом воды, а также по реакции между цинком и соляной кислотой. Однако чаще используют готовый заводской Водород в баллонах.
Применение Водорода. В промышленном масштабе Водород стали получать в конце 18 века для наполнения воздушных шаров. В настоящее время Водород широко применяют в химической промышленности, главным образом для производства аммиака. Крупным потребителем Водорода является также производство метилового и других спиртов, синтетического бензина и других продуктов, получаемых синтезом из Водорода и оксида углерода (II). Водород применяют для гидрогенизации твердого и тяжелого жидкого топлив, жиров и других, для синтеза HCl, для гидроочистки нефтепродуктов, в сварке и резке металлов кислородо-водородным пламенем (температура до 2800°С) и в атомно-водородной сварке (до 4000°С). Очень важное применение в атомной энергетике нашли изотопы Водорода - дейтерий и тритий.
110 Аммиак, строение, получение и свойства. Донорно-акцепторный механизм образования иона аммония. Соли аммония, азотные удобрения.
Аммиа́к — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта). Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. 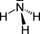
Хим.св-ва: Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
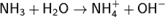
Взаимодействуя с кислотами даёт соответствующие соли аммония:
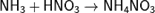
Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH2−, называются амидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
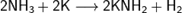
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Аммиак в основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности.
