Безопасности лекарственных средств
Вопросы качества, эффективности и безопасности лекарственных средств в настоящее время находятся в центре внимания законодателя. Статья 4 Федерального закона «О лекарственных средствах» определяет основные понятия, связанные с качеством и безопасностью лекарственных средств.
Качество лекарственных средствопределяется как соответствие лекарственных средств государственному стандарту их качества. Документом, подтверждающим соответствие качества лекарственного средства государственному стандарту, является сертификат качества лекарственного средства.
Безопасность означает характеристику лекарственных средств, основанную на сравнительном анализе их эффективности и оценке риска причинения вреда здоровью. Эффективность лекарственных средств, в свою очередь, означает характеристику степени положительного влияния на течение болезни.
Фальсифицированное лекарственное средствоопределено как ЛС, сопровождаемое ложной информацией о составе или производителе лекарственного средства.
Понятие недоброкачественного лекарственного средстваподразумевает негодность или истечение срока годности ЛС.
Согласно статье 8 Федерального закона «О лекарственных средствах» государственному контролю подлежат все лекарственные средства, произведенные на территории РФ и ввозимые из-за рубежа. Порядок осуществления государственного контроля качества лекарственных средствна территории РФ регламентируется в настоящее время приказом Министерства здравоохранения РФ от 04 апреля 2003 г. № 137.
Данным нормативным актом предусмотрены следующие виды государственного контроля качества лекарственных средств: предварительный, выборочный и повторный выборочный, контроль качества фармацевтических субстанций, а также периодические проверки производителей с целью инспектирования качества выпускаемых ими ЛС.
Предварительному контролю качестваподлежат следующие ЛС: впервые производимые организацией на территории РФ; впервые ввозимые на территорию РФ из-за рубежа; выпускаемые по измененной технологии; выпускаемые после перерыва более 3 лет; в связи с ухудшением их качества.
Процедура предварительного контроля качества включает в себя следующие этапы:
♦ направление организацией-производителем в Росздравнадзор России заявки с пакетом необходимых документов;
♦ анализ документов и выдача Росздравнадзором разрешения на проведение предварительного контроля качества;
♦ отбор образцов для целей предварительного контроля качества;
♦ направление образцов на экспертизу качества;
♦ проведение экспертизы качества представленных образцов;
♦ принятие Росздравнадзором решения по результатам проведенной экспертизы качества.
Для получения решения о направлении на предварительный контроль качества ЛС организация-производитель направляет в Росздравнадзор вместе с заявкой следующий пакет документов: заверенную копию регистрационного удостоверения; заверенные копии титульных листов государственного стандарта качества и согласованного в установленном порядке технологического регламента производства; копию аттестата контрольных лабораторий отдела контроля качества (ОКК) организации-производителя на техническую компетентность в области контроля качества производимых ЛС.
Решение о направлении на проведение предварительного контроля выдается Росздравнадзором в течение 20 рабочих дней с даты поступления заявки и документов.
Организации-производители, впервые начинающие серийный выпуск ЛС, должны направить на предварительный контроль качества образцы первых 3 промышленных серий этого ЛС по мере их наработки. Если предварительный контроль качества проводится в связи с ухудшением его качества, контролю подлежат 5 очередных серий ЛС.
Организации, осуществляющие упаковку или расфасовку ЛС, созданных другими производителями (отечественными или зарубежными), направляют на предварительный контроль качества образцы трех промышленных серий упакованного или расфасованного ЛС.
При изменении наименования лекарственного средства организация-производитель направляет на предварительный контроль качества одну серию переименованного лекарственного средства.
Экспертиза качества лекарственного средства проводится в срок, не превышающий 30 рабочих дней со дня поступления образцов и комплекта документов, если в государственном стандарте качества не предусмотрены методы, требующие более длительных сроков выполнения экспертизы. По окончании экспертизы качества ее результаты с протоколом анализа направляются в Росздравнадзор России и организации-производителю.
Лекарственное средство снимается с предварительного контроля качества и переводится на выборочный, если качество всех представленных образцов соответствует требованиям государственного стандарта качества для него.
На основании решения Росздравнадзора о снятии ЛС с предварительного контроля качества, а также по результатам экспертизы эффективности и безопасности Росздравнадзором оформляется решение о выпуске ЛС в обращение на территории РФ. Данное решение является основанием для выдачи организации-производителю заключения Росздравнадзора о соответствии организации производства ЛС требованиям Федерального закона «О лекарственных средствах».
При наличии замечаний к качеству лекарственного средства по результатам проведения экспертизы качества оно не подлежит снятию с предварительного контроля.
Выборочному контролю качестваподлежат лекарственные средства отечественного и зарубежного производства, находящиеся в обращении в РФ.
Номенклатура и периодичность отбора образцов на выборочный контроль качества регламентируются планом выборочного контроля, который доводится до сведения организаций-производителей в виде планов-заданий. В течение календарного года план-задание может корректироваться с учетом изменения номенклатуры ЛС, находящихся в обращении в РФ, или выявленного несоответствия их качества требованиям государственных стандартов качества.
Процедура выборочного контроля качества ЛС включает следующие этапы:
♦ принятие Росздравнадзором решения о проведении выборочного контроля качества ЛС в соответствии с утвержденным планом;
♦ отбор образцов для целей выборочного контроля качества;
♦ направление образцов на экспертизу качества;
♦ проведение экспертизы качества представленных образцов;
♦ принятие Росздравнадзором решения по результатам проведенной экспертизы качества.
Экспертиза качества проводится в срок, не превышающий 40 рабочих дней со дня получения образцов ЛС и комплекта документов, если в государственном стандарте качества не предусмотрены методы контроля, требующие более длительных сроков их выполнения. Результаты экспертизы в рамках выборочного контроля качества ЛС направляются в Росздравнадзор и организации-производителю.
При выявлении несоответствия качества ЛС требованиям государственного стандарта Росздравнадзор направляет информацию об изъятии партии некачественного ЛС в территориальные органы контроля качества, которые принимают меры к выявлению и изъятию его из обращения.
Выборочный контроль качества сертифицированных лекарственных средств, находящихся в обращении на территории РФ, при поступлении их по месту назначения осуществляется территориальными органами контроля качества в рамках инспекционного контроля. В ходе инспекционной проверки проводится выборочный контроль качества по показателям «описание», «упаковка», «маркировка», проверяется происхождение, соответствие сопроводительной документации и государственному стандарту качества, принадлежность к данной партии ЛС.
При возникновении сомнений в достоверности данных, полученных в результате проверки сопроводительной документации и контроля качества ЛС, проводятся дополнительные испытания. Их объем для выборочной проверки в каждом конкретном случае определяется территориальным органом контроля качества. Территориальный орган контроля качества лекарственных средств представляет в Росздравнадзор информацию о случаях выявления несоответствия качества ЛС требованиям государственных стандартов, незаконных копий или подделок зарегистрированных в РФ лекарственных средств, а также направляет ежемесячный отчет о результатах проверок качества сертифицированных ЛС.
Повторному выборочному контролю качестваподлежат ЛС в случае возникновения споров об их качестве между субъектами обращения. Он проводится по решению Росздравнадзора России.
Процедура повторного выборочного контроля включает следующие этапы:
♦ направление организацией-производителем в Росздравнадзор заявки на повторный выборочный контроль качества ЛС и необходимых документов с обоснованием его проведения;
♦ рассмотрение Росздравнадзором представленных документов и принятие решения о проведении повторного выборочного контроля качества ЛС;
♦ отбор образцов ЛС для повторного выборочного контроля их качества;
♦ направление образцов на экспертизу качества;
♦ проведение экспертизы качества представленных образцов;
♦ принятие Росздравнадзором решения по представленным результатам экспертизы качества.
На повторный выборочный контроль качества лекарственные средства могут направляться предприятием, выявившим их несоответствие требованиям государственных стандартов качества, а также организацией-производителем, направляющей на повторный выборочный контроль архивные образцы данного ЛС.
Решение о проведении повторного выборочного контроля качества лекарственного средства принимается Росздравнадзором в течение 20 рабочих дней с даты поступления заявки и документов.
Экспертиза качества лекарственного средства для целей повторного выборочного контроля проводится в срок не более 20 рабочих дней со дня получения образцов и комплекта документов, если в государственном стандарте качества не предусмотрены методы контроля, требующие более длительных сроков.
Результаты экспертизы качества ЛС с протоколом анализа направляются в Росздравнадзор России и субъектам обращения, представившим образцы на повторный выборочный контроль качества.
Государственный контроль качества фармацевтических субстанцийпроводится на этапе их регистрации, а также в рамках предварительного и выборочного контроля их качества как лекарственных средств на основании решения Росздравнадзора. Экспертизе качества подлежат все субстанции на этапе их регистрации, а также субстанции, ввозимые на территорию РФ и предназначенные для изготовления лекарственных средств.
Экспертиза качества субстанций проводится в срок не более 30 рабочих дней со дня получения образцов субстанции и стандартных образцов веществ, необходимых для проведения экспертизы качества, если в государственном стандарте не предусмотрены методы контроля, требующие более длительных сроков. Разъяснения вопросов, связанных с контролем субстанций, содержатся в письме Департамента государственного контроля лекарственных средств и медицинской техники Минздрава России от 04 марта 2004 г. № 295-22/37.
Образцы ЛС для проведения предварительного, выборочного и повторного выборочного контроля качества отбираются специалистами Росздравнадзора или учреждений, входящих в государственную систему контроля качества, эффективности и безопасности.
Отбор образцов отечественных ЛС для предварительного и выборочного контроля качества осуществляется из архивных образцов лекарственных средств ОКК организации-производителя. Отбор образцов на выборочный контроль качества может проводиться также при проверках организации-производителя. Отбор образцов зарубежных ЛС на выборочный контроль качества проводится со складов на территории РФ, указанных зарубежной организацией-производителем.
Порядок направления образцов на государственный контроль качества лекарственных средств.Образцы лекарственных средств направляются на государственный контроль качества в упаковке, предусмотренной государственным стандартом; образцы субстанций — в таре из стекла. Маркировка образцов лекарственных средств должна соответствовать требованиям государственных стандартов качества.
На предварительный и выборочный контроль качества и контроль качества субстанции на этапе регистрации образцы направляются в количестве, достаточном для проведения трех анализов в соответствии с требованиями государственного стандарта качества (с учетом испытания па микробиологическую чистоту). Образцы ЛС для инъекций и глазных капель направляются с учетом испытаний показателя «механические включения», а образцы лекарственного растительного сырья — с учетом результатов радиационного контроля.
Образцы ЛС, направляемых на предварительный или выборочный контроль качества, а также образцы субстанций должны сопровождаться стандартными образцами субстанций и веществ, необходимых для проведения контроля в соответствии с государственными стандартами качества. Образцы субстанции направляются в количестве, достаточном для проведения двух анализов.
На выборочный контроль качества образны отечественных ЛС направляются с архивным образцом субстанции в количестве, достаточном для проведения двух анализов в соответствии с утвержденным государственным стандартом.
На повторный выборочный контроль качества ЛС организация-производитель направляет образцы в ненарушенной упаковке. Количество упаковок, составляющих образец, рассчитывается по формуле: 0,4 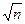 , где п — количество упаковок в одной серии, но не более 30. Количество образцов ЛС, направляемых на повторный выборочный контроль качества по показателям «механические включения» и «радиационный контроль», определяется соответствующими государственными стандартами качества.
, где п — количество упаковок в одной серии, но не более 30. Количество образцов ЛС, направляемых на повторный выборочный контроль качества по показателям «механические включения» и «радиационный контроль», определяется соответствующими государственными стандартами качества.
Образцы ЛС направляются на государственный контроль качества с сопроводительным письмом, в котором указывается вид контроля качества, с сертификатом качества организации-производителя и актом отбора образцов. Образцы для инъекций и глазных капель, направляемые на предварительный контроль качества, кроме вышеуказанных документов должны сопровождаться результатами проверки качества указанных ЛС по показателю «механические включения». Результаты такой проверки представляют территориальные органы контроля качества.
Образцы субстанций, из которых произведены ЛС, представляемые на предварительный и выборочный контроль качества (для отечественных организаций-производителей), должны сопровождаться сертификатом качества, выданным по результатам контроля качества субстанции при ее поступлении в производство по всем показателям, оригиналом или заверенной копией сертификата качества ЛС; а для зарубежных субстанций дополнительно должны быть указаны даты изготовления и окончания срока годности.
Образцы, оставшиеся после проведения государственного контроля качества лекарственных средств, хранятся не менее 6 месяцев, после чего образцы, не удовлетворяющие требованиям государственного стандарта качества, подлежат уничтожению. Образцы ЛС, удовлетворяющие требованиям государственных стандартов качества, возвращаются организациям-производителям по их письменной просьбе либо используются в научно-исследовательских целях или безвозмездно передаются в учреждения здравоохранения по их письменным заявкам.
