Лейкоциты, классификация и функции. Защитная функция крови, фагоцитоз. Тромбоциты и их функции. Свертывание крови. Фибринолиз. Группы крови человека
Лейкоциты формируют в организме человека мощный кровяной и тканевой барьеры против микробной, вирусной и паразитарной инфекции.
Лейкоциты, или белые кровяные тельца - это клетки с ядрами, не содержащие гемоглобина. В 1 мкл крови здорового человека содержится 4000-10000 лейкоцитов (4-9 109/л). Большая часть лейкоцитов (более 50%) находится за пределами сосудистого русла, в межклеточном пространстве, более 30% - в костном мозге. Процес образования и созревания лейкоцитов называется лейкопоэзом. Увеличение количества лейкоцитов называется лейкоцитозом, уменьшение - лейкопенией. Различают физиологический и реактивный лейкоцитоз. Первый чаще всего наблюдается после приема пищи, мышечной работе, беременности, сильных эмоциях. Второй вид лейкоцитоза характерен для воспалительных процессов и инфекционных заболеваний. Лейкопения (наиболее тяжелая форма – агранулоцитоз) приводит к резкому снижению защитных сил организма. При лейкопении прежде всего уменьшается число нейтрофилов, как за счет подавления лейкопоэза, так и в следствие усиленного удаления лейкоцитов из крови. Лейкопения наблюдается при некоторых инфекционных заболеваний. Выявленная в последние годы неинфекционная лейкопения связана главным образом с повышением радиационного фона, широким применением ряда лекарственных препаратов (цитостатики, анальгин). Злокачественная, неконтролируемая пролиферация лейкоцитов, ведущая к увеличению числа малодифференцированных клеток, не способных выполнять свою функцию наблюдается при лейкозах.
В зависимости от того, содержит ли цитоплазма зернистость (т.е. многочисленные лизосомы и секреторные гранулы) или она однородна, лейкоциты делятся на две группы: гранулоциты и агранулоциты.
ГРАНУЛОЦИТЫ - образуются в костном мозге и составляют 60% всех лейкоцитов крови. Срок жизни 2 суток. Гранулоциты в свою очередь, подразделяются на три вида: эозинофилы, гранулы которых окрашиваются в розовый цвет кислым красителем эозином; базофилы - гранулы окрашиваются в синий цвет основными красителями; нейтрофилы, гранулы воспринимают те и другие краски.
1. Нейтрофилы или нейтрофильные лейкоциты составляют 93-96% от всех гранулоцитов. Так как с возростом клеток изменяется форма их ядра, их еще называют полиморфноядерные лейкоциты. Часть гранул нейтрофилов представлена лизосомами, содержащими многочисленные энзимы: лизоцим, повреждающий стенку бактерий; катионные белки, нарушающие дыхание и рост микроорганизмов; протеазы и кислые гидролазы, позволяющие переваривать захваченные объекты. Другие гранулы содержат энзимы, участвующие в процессах регенерации тканей.
Нейтрофилы являются самыми важными функциональными элементами неспецифической защитной системы крови. Они способны быстро мигрировать и накапливаться в инфицированном или поврежденном участке тела, где они фагоцитируют, а затем убивают и переваривают бактерии. Выбор направления движения обусловлен появлением в участке повреждения хемотаксических факторов. Под влиянием этих факторов или хемоаттрактантов клетки поляризуются и начинают ползти по направлению к источнику аттрактанта. В результате большое количество лейкоцитов переходит в пораженную ткань. Самым мощным хемотаксическим эффектом обладают лейкотриены, они секретируются активированными Т-лимфоцитами (хелперами) после воздействия на них бактериальных агентов. Нейтрофилы способны получать энергию путем анаэробного гликолиза, поэтому могут существовать в очагах воспаления, бедных кислородом. Бактерицидный эффект нейтрофилов связан с возникающим в них через 30-60 секунд после контакта бактериального агента с мембраной нейтрофила "метаболическим (дыхательным) взрывом", при котором резко увеличивается потребление кислорода и образуются активные формы кислорода (АФК), являющихся сильными окислителями. Этот процесс инициируется НАДФН-оксидазой, катализирующей реакцию между восстановленным пиридиннуклеотидом и молекулярным кислородом в результате чего образуется перекись водорода и супероксидный анион-радикал. АФК, в частности анион-радикал кислорода, являются эффективными хемоаттрактантами. Нейтрофилы содержат в так называемых азурофильных гранулах большое количество фермента миелопероксидазы (5 % от сухого веса клеток). При фагоцитозе, сопровождающимся обязательной активацией фагоцитирующих клеток и развитием дыхательного взрыва, МПО секретируется вместе с АФК как во внеклеточную среду, так и в фагосому. В обоих компартментах МПО усиливает окислительный потенциал АФК, катализируя образование различных гипогалитов, при этом пероксид водорода используется как ко-субстрат в соответствии со следующим уравнением:
Cl-+ H2O2 + H+ 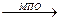 HOCl + H2O
HOCl + H2O
Именно с продукцией гипохлорита (HOCl), который является чрезвычайно эффективным бактерицидным агентом, токсичным для бактерий даже в концентрации 50 мкМ, связывают участие МПО в процессах неспецифического иммунитета. Бактерицидный эффект нейтрофилов связан также с разрушением бактерий и продуктов распада тканей лизосомными ферментами. Образующийся в очагах воспаления гной состоит, главным образом, из нейтрофилов и их остатков.
2. Базофильные гранулоциты составляют 0,5-1% всех лейкоцитов крови. Эти клетки способны к фагоцитозу и миграции из кровяного русла в ткани. Могут накапливать в гранулах биологически активные вещества, очищая от них ткани. Базофилы способны выделять гистамин, который участвует в формировании аллергических реакций. Эти реакции развиваются при повторном воздействии нетоксических антигенов. При аллергии через нескольких минут самое большее часов наблюдается покраснения кожи, появляются сыпи, иногда развиваются спазмы легких (например, при воздействии пыльцы - сенная лихорадка) и в крайних случаях аллергия приводит к анафилактическому шоку.
3. Эозинофильные гранулоциты составляют 2-4% всех лейкоцитов крови. Они обладают фагоцитарной и бактерицидной активностью и способны убивать микроорганизмы и более крупных паразитов, например личинок глистов (аскарид, трихинелл), благодаря целому ряду механизмов и в первую очередь - продукции пероксида водорода. Эозинофилы уменьшают концентрацию биологически активных соединений, возникающих при аллергии, т.е. являются антагонистами базофилов.
АГРАНУЛОЦИТЫ - в цитоплазме этих лейкоцитов при окрашивании зернистость не выявляется. Они представлены лимфоцитами и моноцитами.
Лимфоциты - составляют 25-40% всех лейкоцитов. Образуются во многих органах: лимфатических узлах, миндалинах, пейеровых бляшках, аппендиксе, селезенке, вилочковой железе (тимусе), но главным образом в костном мозге. Лимфоциты играют ключевую роль в иммунитете (след. лекция).
Моноциты - 4-8% всех лейкоцитов крови. Образуются в костном мозге. Способность к фагоцитозу у них более выражена, чем у других форменных элементов крови. Из крови выходят в окружающие ткани - здесь растут, в них увеличивается содержание лизосом и митохондрий. Достигнув зрелости, превращаются в неподвижные клетки - тканевые макрофаги. Макрофаги способны функционировать в анаэробных условиях. Их цитотоксические свойства связаны с развитием дыхательного взрыва, в ходе которого образуются анион радикал кислорода, Н2О2, гидроксильный радикал (•ОН) и другие формы активного кислорода и азота, в том числе монооксид азота (NO). Кроме того, макрофаги секретируют более 100 биологически активных соединений. Вблизи очага воспаления эти клетки могут размножаться делением. Тканевые макрофаги образуют ограничивающий вал вокруг тех инородных тел, которые не могут быть удалены с помощью фагоцитоза. Остеокласты (специализированные макрофаги костной ткани) применяют АФК для разрушения кости - обязательного условия ее обновления. Во всех этих случаях клетки-защитники быстро поглощают большое количество О2, используют его для образования АФК при помощи расположенной в плазматической мембране НАДФН-оксидазы дыхательного взрыва. Важное значение АФК для защиты от бактерий доказывается тем, что при инактивирующей мутации этого фермента возникает хронический септический грануломатоз: фагоцитированные микроорганизмы остаются живыми, что приводит к повторным хроническим инфекциям и чревато сепсисом.
При инфекционных заболеваниях наблюдаются характерные изменения в содержании и соотношении различных форм лейкоцитов. При остром инфекционном заболевании на начальном этапе – нейтрофильный лейкоцитоз и снижение числа лимфоцитов и эозинофилов, затем возрастает количество моноцитов и это свидетельствует об успешной борьбе организма с инфекцией и в заключительный период болезни, при окончательном выздоровлении увеличивается содержание лимфоцитов и эозинофилов, очищающих организм от токсинов.
Тромбоциты
Тромбоциты или кровяные пластинки это плоские, безъядерные клетки с большим диаметром 1-4 мкм и толщиной 0,5-0,75 мкм. В норме один мкл крови содержит от 150 до 300 тыс. тромбоцитов. Образуются в костном мозге из гигантских клеток – мегакариоцитов (а те из стволовых). Из одного мегакариоцита может образоваться до 1000 тромбоцитов. В кровяных пластинках содержатся специфические гранулы, содержащие серотонин и вещества, участвующие в свертывании крови. Кровяные пластинки циркулируют в кровяном русле 5-11 дней и затем разрушаются в печени, легких, селезенке. Обычно тромбоциты пребывают в крови в неактивном состоянии (в норме неповрежденный эндотелий сосудов вырабатывает NO – фактор ингибирующий агрегацию тромбоцитов) и активируются только при необходимости остановки кровотечения и свертывания крови (гемостаз).
Гемостаз
У здорового человека кровотечение из мелких сосудов останавливается за 1-3 мин. Этот первичный гемостаз почти целиком обусловлен сужением сосудов и их механической закупоркой агрегатами тромбоцитов. При этом под действием специального фактора гликопротеидной природы, содержащегося как в тромбоцитах, так и эндотелиальных клетках, выстилающих внутреннюю поверхность сосудов, происходит адгезия (прилипание) тромбоцитов к волокнам соединительной ткани по краям раны и друг другу (агрегация). При адгезии и агрегации тромбоцитов из них высвобождается серотонин, который вызывает сокращение мелких сосудов и препятствует кровотечению. После того как образовался тромбоцитарный сгусток, просвет сосудов увеличивается до нормального уровня, но вымыванию сгустка и возобновлению кровотечения препятствуют процессы коагуляции т.е. превращения фибриногена в волокна и далее волокнистую сеть фибрина, служащего основой для образования тромба. Тромб представляет собой плотный сгусток из нитей фибрина. Фибрин образуется из фибриногена в результате его активации ферментом тромбином, последний в свою очередь образуется из протромбина под действием ряда ускоряющих факторов.
Лекция 15
Иммунитет
Иммунитетом называют способ защиты организма от живых тел и веществ, несущих в себе признаки генетической чужеродности (белковые токсины и другие макромолекулы, вирусы, микроорганизмы, простейшие, грибы, черви, клетки, в т.ч. раковые; ткани, в т.ч. пересаженные органы). Иммунитет специфичен: например, тот кто переболел корью, защищен от вируса кори, но не от других распространенных вирусов, таких как возбудители ветряной оспы или свинки. Такого рода специфичность - фундаментальная особенность иммунных реакций. Поскольку иммунные реакции направлены на разрушение, важно, чтобы они запускались только чуждыми организму, но не собственными молекулами. Способность отличать чужое от своего - второе фундаментальное свойство иммунной системы. Изредка случается, что она принимает "свое" за "чужое" и начинает разрушительные действия против собственных молекул организма и развиваются аутоиммунные заболевания, например, упомянутая в одной предыдущих лекций миастения). Как правило, аутоиммунные заболевания имеют очень тяжелые последствия и часто приводят к смертельному исходу.
Различают неспецифические и специфические защитные механизмы. К факторам неспецифической резистентности можно отнести кожу, слизистую, секрет потовых, сальных, слюнных желез (содержит разнообразные бактерицидные вещества), желез желудка (соляная кислота и протеолитические ферменты), нормальную микрофлору (антагонисты патогенных микроорганизмов). Неспецифические защитные механизмы способны обезвреживать даже такие инородные тела, с которым организм ранее не сталкивался. Специфические механизмы, наоборот, включаются только после первичного контакта с инородным телом.
Неспецифический клеточный иммунитет обусловлен, главным образом, наличием в крови лейкоцитов и их фагоцитарной активностью. Способностью к фагоцитозу обладают гранулоциты (нейтрофилы) и моноциты, В 1976 г в лимфоидной ткани была открыта неспецифическая противоопухолевая активность (особенно против лейкемий). Клетки, обладающие этой активностью называют природными (естественными) киллерами. Это большие гранулярные лимфоциты, в гранулах которых содержится белок перфорин, проделывающий дыры в мембранах клеток-мишеней.
Неспецифический гуморальный иммунитет обусловлен наличием в полиморфноядерных лейкоцитах и в макрофагах легких, а также во многих тканях и жидкостях, белка лизоцима, способного эффективно подавлять развитие и рост бактерий и вирусов, интерферона, обладающегопротивовирусным действием и системы белков комплемента. С действием комплемента связана резистентность организма к бактериям, населяющим желудочно-кишечный тракт. Липополисахариды из клеточных стенок этих бактерий (эндотоксины) связываются пропердином, который активирует (расщепляет) компонент С3 системы комплемента по т.н. альтернативному пути. Продукты распада комплемента и пропердина опсонизируют (см. ниже) чужеродные агенты, что облегчает их фагоцитоз. Классический путь активации комплемента относится к специфическим защитным механизмам, поскольку требует присутствия антител.
Специфические защитные механизмы или собственно иммунитет обусловлены строго избирательными реакциями - иммунными ответами. Иммунный ответ – это сложная многокомпонентная, кооперативная реакция иммунной системы организма, индуцированная антигеном и направленная на его элиминацию.
Иммунитет у позвоночных обеспечивается системой, имеющей двойственный характер и представляющий собой два основных способа защиты от чужеродного вторжения. В обоих случаях возникает специфическая реакция на большинство чужеродных веществ, хотя один вид ответа обычно преобладает. Клеточный иммунный ответ особенно эффективен против грибов, паразитов, внутриклеточных вирусных инфекций, раковых клеток и чужеродных тканей. Гуморальный иммунный ответ проявляется преимущественно в период внеклеточной фазы бактериальных и вирусных инфекций.
Иммунной системой называют совокупность лимфоидных органов, тканей, а также иммунокомпетентных клеток, вместе с продуктами их жизнедеятельности, обеспечивающих механизмы иммунитета. Лимфоидные органы подразделяют на центральные - вилочковая железа (тимус) и красный костный мозг; и периферические: лимфатические узлы, селезенка, лимфоидная ткань кишечника (аппендикс, пейеровы бляшки), носоглотки (миндалины). Иммунокомпетентными клетками являются две популяции лимфоцитов: В- и Т-клетки, а также макрофаги.
Лимфоциты развиваются из стволовых клеток, которые находятся главным образом в костном мозге. У птиц В-клетки созревают в фабрициевой сумке (bursa), отчего и получили свое название. Процесс образования В-клеток у млекопитающих полностью протекает в самом костном мозге (bone marrow). Здесь они приобретают антигенную специфичность, что связано с появлением на мембране этих клеток рецепторов, способных взаимодействовать с конкретными антигенами. Что касается Т-клеток, то на протяжении всей жизни костный мозг поставляет в кровь и оттуда в тимус предшественников Т-клеток. В тимусе Т-клетки приобретают поверхностные рецепторы к различным антигенам (в процессе созревания 90% лимфоцитов в тимусе погибает). Лимфоциты, обладающие антигенной специфичностью, выходят в кровь и заселяют периферические лимфоидные органы. Здесь Т- и В-клетки реагируют на свои антигены пролиферацией и последующей дифференцировкой в эффекторные Т-лимфоциты, уничтожающие антиген и активированные В-лимфоциты или плазматические клетки - продуценты антител. Любой антиген воздействует лишь на ничтожную долю всех лимфоцитов имеющих специальные рецепторы для связывания этого конкретного антигена. Поэтому Т- и В-лимфоциты не отличаются оседлостью и для того чтобы обеспечить встречу антигена с немногочисленной группой чувствительных к нему клеток лимфоциты перемещаются непрерывно между кровью и лимфой. Однако не все образующиеся в результате пролиферации лимфоциты вовлекаются в иммунные реакции. Часть Т- и В-клеток сами не дают ответа, но легко превращаются в активные клетки при следующей встрече с тем же антигеном. Это клетки иммунной памяти, которые циркулируют в крови до 10 лет и более. Они хранят информацию о всех антигенных воздействиях и обуславливают длительную устойчивость организма к ранее перенесенным инфекционным заболеваниям.
К макрофагам относятся перитонеальные, легочные, купферовские клетки печени, клетки Лангерганса, остеокласты, клетки микроглии и др. В их функции входит захват вторгшихся в организм чужеродных веществ для презентации (представления) их лимфоцитам, и выведение из организма чужеродных агентов, атакованных иммунной системой.
Иммунная система выработалась в процессе эволюции позвоночных животных как средство защиты от заражения микроорганизмами и более крупными паразитами; однако почти любая макромолекула, чуждая организму реципиента, может вызвать иммунный ответ. Вещество, способное вызвать иммунный ответ, называют антигеном. Антигены состоят из крупной неспецифической молекулы переносчика (полисахарида, белка, липида с М.В. более 10000) и расположенных на поверхности детерминантных групп. Число детерминантных групп может быть очень большим - несколько сотен, даже тысяч. Антигенным свойством обладает не вся молекула антигена, а только детерминантные группы. (Детерминантные группы, отделенные от макромолекулы-переносчика, называют гаптенами. Гаптены реагируют с соответствующими антителами, но не запускают синтез новых антител. Гаптенами являются многие лекарства). Самое удивительное, что иммунная система может различать даже очень сходные антигены, например два белка, различающиеся только одной аминокислотой, или два оптических изомера.
Индивидуальные В-клетки, активированные в процессе распознавания чужеродного агента, дифференцируются в плазматические клетки, секретирующие антитела.
Антитела- продукты гуморального иммунного ответа, сывороточные γ-глобулины, специфически реагирующие с антигеном, вызвавшим их образование и вызывающие цепь реакций, направленных на его элиминацию из организма. Это сложные белковые образования, мономеры или полимеры. Молекулы иммуноглобулинов состоят из двух параллельных цепочек: двух тяжелых и двух легких. Существует 5 типов тяжелых цепей - они клоноспецифичны и обозначаются буквами греческого алфавита - γ, μ, α, δ, ε и2 типалегких цепей - κ и λ. Любой иммуноглобулин имеет как минимум 2 активных центра, а если молекулы объединены в полимер - и более. Иммуноглобулины разделяют на классы, а те, в свою очередь, на подклассы. Класс иммуноглобулина соответствует типу тяжелой цепи - следовательно, существует 5 классов иммуноглобулинов: IgG (γ), IgM (μ), IgA (α), IgD (δ), IgE (ε). В полимерных формах IgA и IgM субъединицы соединяются между собой дисульфидными связями через полипептид, называемый J-цепью.
Антитела циркулируют в крови и проникают в другие жидкости организма, где специфически связываются с чужеродными антигенами. Связывание с антителами инактивирует вирусы и бактериальные токсины (такие, как столбнячный или ботулинический), блокируя их способность присоединяться к рецепторам на клетках мишенях. Антитела, связанные с более крупными объектами - микроорганизмами и личинками паразитов, а также собственными инфицированными клетками служат "метками", указывающими на цели, подлежащие уничтожению фагоцитами и комплементом. Этот процесс подготовки чужеродных частиц к их поглощению фагоцитами называется опсонизацией.
В зависимости от путей реализации иммунный ответ разделяют на гуморальный и клеточный, однако в чистом виде ни один из них не проявляется. Гуморальные иммунные ответы (ГИО) связаны с увеличением продукции антител специфичных для данного антигена В-лимфоцитами.
IgM - первые антитела, образующиеся в ответ на иммуноген. Они представляют собой пентамер основной структурной единицы. IgM особенно эффективны против вторгшихся микроорганизмов. Хотя сродство каждого активного центра к родственной антигенной детерминанте может быть низким, общая авидность пентамера к комплексному антигену очень высока. Благодаря пентамерной структуре молекула IgM во много раз эффективнее агглютинирует (склеивает) клетки, чем мономерные бивалентные антитела. Кроме того, IgM, связанные с клеткой-мишенью способствуют ее перевариванию макрофагами и разрушению в результате связывания комплемента. Вследствие своих крупных размеров IgM находятся только в крови, не проникают в интерстициальную жидкость, не проходят через плаценту и не попадают в циркуляцию плода.
IgG представляют собой мономерные антитела, которые появляются в процессе иммунного ответа позже, чем IgM. Антитела IgG класса содержатся в наибольшем количестве в крови и межтканевых пространствах. Превалирование этих антител в кровотоке определяют их основную роль в активации системы комплемента, хотя они менее эффективны чем IgM. IgG – единственный класс антител, способный проникать через плаценту и обеспечивать защиту плода.
IgA, продуцируются при иммунном ответе также позднее, чем IgM. Это основной иммуноглобулин молозива, молока, функция которого защита желудочно-кишечного тракта грудных детей. Также он обнаружен в слюне, слезах, поте.
IgD и IgE присутствуют в крови в следовых количествах. IgD являются главным мембранным рецептором В-клеток. IgE подготавливают тучные клетки и базофилы к участию в аллергических реакциях. Они прикрепляются к поверхности этих клеток и когда связывают антиген, то вызывают дегрануляцию базофилов.
Существуют два варианта ГИО. Если ответ происходит на Т-независимые антигены, то это т.н. простой ответ. Он возможен потому, что некоторые антигены сами способны активировать В-лимфоциты (обычно эти антигены поливалентны, т.е. имеют повторяющиеся антигенные детерминанты, например, бактериальные липополисахариды). В этом случае синтезируются исключительно поливалентные IgM и не образуется В-клеток памяти. Ответ В-клеток на большинство белковых антигенов полностью Т-зависим, т.е. требуется для его реализации требуется кооперация В- и Т-лимфоцитов, а также других вспомогательных антигенпрезентирующих клеток.
Т-клетки, которые кооперируют в процессе синтеза антител с В-клетками, принадлежат к классу Т-клеток хелперов (ТН), т.е. помощников. Наряду с ТН-клетками, стимулирующими ГИО, существует класс Т-клеток супрессоров (ТS), которые подавляют продукцию антител В-лимфоцитами.
Помимо хелперной и супрессорной функций в ГИО существуют еще ряд Т-клеточных функций, необходимых для возникновения клеточного иммуннного ответа. Реакции клеточного типа направлены против собственных клеток, заряженные вирусами, опухолевых и чужеродных клеток (трансплантантов), а также некоторых микроорганизмов. Клеточный иммунный ответ осуществляется несколькими классами Т-клеток. Класс цитотоксичных (cytotoxic) ТС-клеток разрушает клетки, несущие на своей поверхности чужеродные антигены гистосовместимости, опухолевые антигены либо вирусоспецифические антигены. Дополнительный класс Т-клеток амплифайеров (amplifier) (ТА) ускоряет созревание антигенспецифических ТС-клеток. Еще один класс Т-клеток (ТD) играет ключевую роль в реакциях гиперчувствительности замедленного (delayed) типа. Для реализации таких реакций необходимо активировать макрофаги, что и происходит под влиянием веществ (лимфокинов), продуцируемых ТD-клеткой. В результате такой активации макрофаги приобретают способность разрушать некоторых внутриклеточных паразитов типа туберкулезной палочки. Такая же активация макрофагов, возможно, играет важную роль в разрушении опухолевых клеток.
Одна из форм гиперчувствительности замедленного типа – контактная чувствительность, наблюдается при нанесении на кожу высокореактивных химических соединений, таких, как тринитрохлорбензол. Это вещество ковалентно связывается с белками кожи, образуя неоантигены. Эти антигены взаимодействуют с макрофагами и Т-лимфоцитами, вызывая их сенсибилизацию. Если через 4-7 дней контакт повторить, то через 24-48 часов после повторного нанесения возникает воспалительная реакция, проявляющиеся в покраснении кожи, образовании мокнущих очагов и волдырей. Неоантигены образуются в коже и при фотоаллергических реакциях. Ряд лекарственных соединений (сульфаниламиды, хлорпромазин и др.) поглощают в ультрафиолетовой области и при УФ-облучении способны фотохимически присоединяться к белкам. Сходные реакции происходят при контакте кожи с украшениями, содержащими никель или с кожаными изделиями, дублеными солями хрома.
У некоторых лиц развивается необычно сильный ответ антителами IgE на антигены, находящиеся во внешней среде, лекарственные препараты или микробные антигены. Повторный контакт с небольшим количеством этих антигенов может вызвать местное или системное высвобождение веществ, содержащихся в тучных клетках. Лица, имеющие такой тип ответа, страдают аллергией. Аллергия (греч. allos - иной, ergon – действие) это форма иммунного ответа, проявляющаяся в повышенной чувствительности к некоторым антигенам (т.н. аллергенам), индуцирующим продукцию IgE. Патологические аллергические реакции возникают в ответ на незначительные дозы антигена и проявляются очень быстро (в считанные минуты), поэтому называются также гиперчувствительностью немедленного типа. Эти реакции сопровождаются такими патологическими симптомами, как повышенная проницаемость капилляров, усиление кровотока в коже и слизистых, появление зудящей сыпи, усиление выделения секрета экзокринных желез и бронхоспазм. Аллергические заболевания могут носить системный или местный характер в зависимости от того, каким способом антиген попадает в организм. Большинство местных проявлений наблюдается на поверхности эпителия в местах проникновения аллергена. Пищевые аллергии возникают в результате реакции комплекса IgE антитела-тучные клетки кишечника на всосавшийся антиген. Эти реакции могут вызывать рвоту, спазмы и диарею. Кожные реакции на комплекс антител IgE с тучными клетками могут быть острыми и хроническими. Острые реакции служат причиной возникновения крапивницы. В результате хронических реакций развивается атопический дерматит. Аллергические реакции верхних дыхательных путей называют сенной лихорадкой. Реакции нижних отделов дыхательных путей обычно возникают в бронхах и бронхиолах, вызывая их спазм и препятствуя вентиляции легких. Они являются причиной бронхиальной астмы. Укусы насекомых причиняют больше вреда тем, что вызывают аллергические реакции, чем прямым действием своих токсинов. У лиц, чувствительных к этим токсинам, в результате укуса пчелы может развиться смертельный анафилактический шок. Анафилактический шок возникает в результате реакции базофилов (тучных клеток крови) с IgE антителами и циркулирующим антигеном. Высвобождение медиаторов тучных клеток вызывает расширение сосудов, в результате происходит скопление крови на периферии и катастрофическое падение кровяного давления (шок). Биологическое значение аллергических реакций неизвестно.
В некоторых случаях возможна ситуация, когда организм не способен по той или иной причине отвечать на определенные антигены. Такая неотвечаемость получила названиеиммунологической толерантности (толерантность – терпимость). Это явление было открыто Медаваром на мышах. Оказалось, что если эмбрионам белых мышей ввести клетки селезенки других линий мышей (черных), то взрослые белые особи, выросшие из этих эмбрионов, не отторгали трансплантаты кожи черных мышей, то есть становились к ним толерантными. Обычные мыши отторгали такие аллогенные трансплантаты. Оказалось, что врожденная толерантность к антигену (толерогену) возникает, когда происходит внутриутробный контакт организма с этим антигеном. В этом случае организм после рождения будет воспринимать данный антиген как «свое». В настоящее время такая толерантность объясняется тем, что в эмбриогенезе происходит гибель клонов-предшественников Т-лимфоцитов, способных взаимодействовать с толерогеном.
Кроме врожденной, существует также и приобретенная толерантность. Чаще всего это обратимый процесс. Приобретенная толерантность бывает 2-х видов: высокодозовая и низкодозовая. Высокодозовая толерантность возникает при попадании в организм больших доз толерогена, особенно введенного на фоне подавления иммунитета (облучение, применение иммунодепрессантов). Такое большое количество антигена вызывать гибель (делецию) реактивных к нему лимфоцитов. Низкодозовая толерантность возникает при введении малых доз определенных антигена. Считается, что в данном случае она опосредована активацией Т-клеток супрессоров, подавляющих иммунную реакцию. В природе толерантность лимфоцитов (как отсутствие ответа на доступный антиген) целесообразна по отношению к веществам, т.е. антигенам собственных тканей организма, что достигается одним из двух механизмов: делецией аутореактивного клона (апоптоз лимфоцитов) и анергией клона.
Апоптоз является физиологическим механизмом селекции клеточных систем организма. Запрограммированная гибель позволяет организму избавляться от клеток с дефектами генов, неадекватным строением рецепторного аппарата, нарушениями дифференцировки. Зрелые полноценные клетки довольно устойчивы к апоптозу. Активация клеток и их старение снижают эту резистентность.
Делецию аутореактивных клонов на стадии лимфопоэза принято называть индукцией центральной толерантности. Так как созревание лимфоцитов происходит непрерывно, то для индукции толерантности необходим постоянный приток аутоантигенов. Если аутоантиген не будет поступать в течение длительного периода времени, произойдет появление «запрещенных» клонов Т- и В-клеток, которые несут рецепторы к собственным антигенам. Например, удаление гипофиза у молодой лягушки приводит к его отторжению при имплантации в зрелом возрасте.
Иногда иммунный ответ на чужеродные антигены может активировать лимфоциты, несущие рецепторы против «своего» и находившиеся до этого в ареактивном состоянии. Например, при ревматизме антигенные детерминанты стрептококков активируют клоны Т-хелперов, которые кооперируют с В-лимфоцитами, синтезирующими антитела, перекрестно реагирующие с антигенами сердечной мышцы (ревмокардит). Сходная ситуация приводит к повреждению головного мозга и нервов (энцефаломиелит), которые могут возникнуть после вакцинации против бешенства, если вакцина приготовлена из ткани мозга иного биологического вида. Антитела против собственных форменных элементов крови (эритроцитов и нейтрофилов) часто возникают в результате применения некоторых лекарственных препаратов (пенициллина, амидопирина, сульфаниламидов). В результате может развиться агранулоцитоз и аутоиммунные гемолитические анемии.
Ряд эндокринных заболеваний связан с тем, что развивается аутоиммунный ответ к антигенам железистых клеток, например при болезни Аддисона возникает клеточный аутоиммунитет к антигенам надпочечников, при юношеском сахарном диабете – к антигенам островков Лангерганса, при болезни Грейвса (форма гипертиреоза) – гуморальный ответ к антигенам щитовидной железы (синтезируются специфические IgG, которые стимулируют ее функцию).
Иммунодефициты — состояния, развивающиеся при нарушении иммунных механизмов — обычно характеризуются постоянным или продолжительным по длительности характером. Различают первичный иммунодефицит (дефект самой иммунной системы), вторичный иммунодефицит (связан с развитием другого заболевания), специфический иммунодефицит (вызван избирательным поражением либо B-лимфоцитов, либо T-лимфоцитов, либо тех и других, т.е. комбинированный иммунодефицит), неспецифический иммунодефицит (вызван сбоем механизмов неспецифического иммунитета).
Причины развития иммунодепрессивных состояний и иммунодефицитов различны.
· Врождённые иммунодефициты — редкие генетические заболевания, характеризующиеся изолированным T- или B-клеточным дефицитом или комбинированным (T- и B-) расстройством.
· Гиперкортицизм (повышенное выделение гормонов коры надпочечников в кровь) возникает в результате значительного повышения содержания глюкокортикоидов в крови.
· Ионизирующая радиация повреждает пролиферирующие иммунокомпетентные клетки.
· Антилимфоцитарная сыворотка. Иммунодепрессивный эффект основан на феномене антителозависимого цитолиза иммунокомпетентных клеток.
· Химические иммунодепрессанты: глюкокортикостероиды, цитостатики (антиметаболиты и алкилирующие агенты), а также антибиотики.
· Инфекционные заболевания. Многие вирусные инфекции (например, грипп, корь и др.) вызывают развитие транзиторных иммунодепрессивных состояний, длящихся недели и месяцы. Иммунодепрессивные свойства вирусов создают предпосылки для развития бактериальных суперинфекций (присоединение новой инфекции на фоне существующей), столь характерных для многих острых респираторных вирусных заболеваний. Особую группу составляют т.н. лимфотропные вирусы, вызывающие Т-клеточные иммунодефициты (ВИЧ-инфекция), в дальнейшем приводящие к тотальной иммунодепрессии (СПИД). При СПИДе вирус иммунодефицита активирует специфический рецептор на Т-хелперах (CD4), ускоряя их апоптоз, что приводит к истощению клеток данного типа.
Многие терапевтические мероприятия могут вызвать иммуносупрессию. Например, широко используются АКТГ и кортикостероидные гормоны для терапии хронических воспалительных заболеваний (например, артритов). Длительное применение этих гормонов приводить к тем же последствиям, что и болезнь Кушинга. Люди, находящиеся в условиях длительного стресса тоже испытывают последствия действие этих гормонов, например, в условиях длительного пребывания на космической станции у космонавтов развивается иммунодефицит.
