Понятие об обратимых и необратимых процессах
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ.
Все процессы в природе можно разбить на две группы — обратимые и необратимые. Если система при прямом и обратном процессе проходит через одни и те же промежуточные состояния, без каких либо изменений в окружающих эту систему телах, то такие процессы называют обратимыми. Любой процесс, не удовлетворяющий этим условиям, называется необратимым. Рассмотрим ряд примеров. Нам известно, что при абсолютно упругом ударе энергия не теряется. Если абсолютно упругий шарик падает на абсолютно упругую плиту в вакууме, то нетрудно понять, что процесс будет обратимым. После отражения шарик вернется в исходное состояние и процесс повторится. Также легко убедиться, что колебания маятника без учета трения можно отнести к разряду обратимых процессов. Но в природе встречается огромное количество процессов, которые носят явно выраженный необратимый характер. Примером может служить диффузия, при которой происходит самопроизвольное выравнивание концентраций. Если в воду бросить кусочек сахара, то он растворится по всему объёму воды. Обратный же процесс сам по себе никогда не произойдет, — молекулы сахара в воде снова в кусочек не соберутся. Конечно, мы можем испарить воду и выделить снова сахар, но это потребует, чтобы в окружающих телах произошли определённые изменения. Так, нагревая воду, мы затратим энергию на нагрев, испарение. Итак, диффузия является односторонним, а тем самым и необратимым процессом.
Опыт показывает, что теплообмен, как и диффузия, является односторонне направленным процессом, носит необратимый характер. Каждому известно, что при теплообмене энергия передается от тел с более высокой температурой к менее нагретым телам, и никогда не наблюдалось, чтобы энергия в форме тепла переходила сама по себе от холодных к горячим телам. Таким образом, без каких либо внешних воздействий в природе невозможен процесс, единственным результатом которого была бы передача энергии в форме тепла от холодного тела к горячему. Это положение называют вторым началом термодинамики. Первое начало говорит о том, что при тепловых процессах энергия сохраняется, а второе начало указывает на направление передачи энергии при теплообмене.
ПОНЯТИЕ ТЕМПЕРАТУРЫ.
С понятием температуры человек сталкивается повседневно. Какой же смысл закладывается в это понятие? При изучении внутренней энергии мы указывали, что температуру можно определять средней кинетической энергией молекул. В основе этого понятия лежит уравнение Wк=3/2хkT. Итак, с микроскопических позиций, когда речь идет об отдельных молекулах, температура выступает как мера средней кинетической энергии движения молекул. На практике определение средней кинетической энергии молекул, следовательно, и температуры в микроскопическом понимании, представляет определенные трудности.
| Рисунок 3 Шкалы температур |
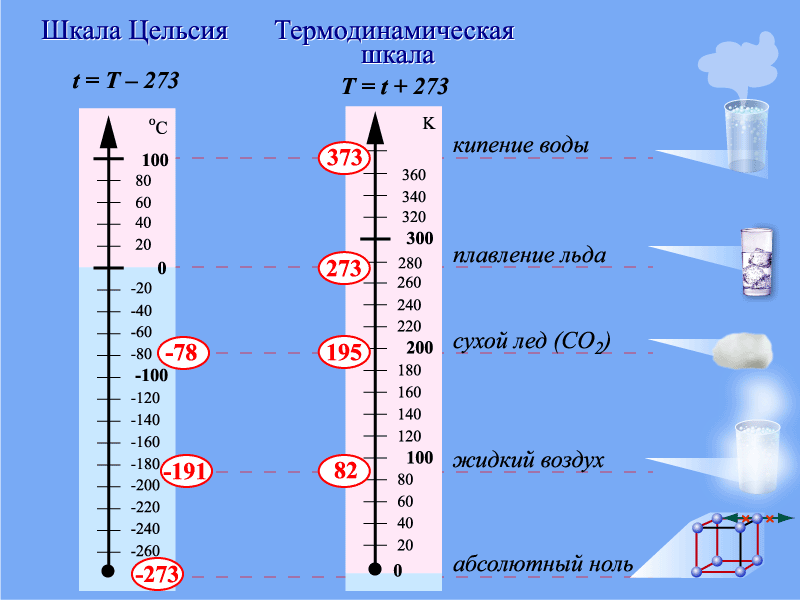 С макроскопических позиций понятие температуры связано со вторым началом термодинамики. Дело в том, что термометры (жидкостные, металлические, газовые) представляют собой макроскопические объекты, которые приводятся в соприкосновение с исследуемым телом. Между телом и термометром начинается теплообмен, который идет до тех пор, пока не сравняются температуры, при этом термометр и тело обмениваются некоторым количеством внутренней энергии. В этом случае температура указывает направление теплообмена. При равенстве температур тела находятся в термодинамическом равновесии, и температура выступает как величина, характеризующая состояние термодинамического равновесия макроскопической системы. Следует заметить, что при термодинамическом равновесии температура в любой части системы имеет одно и то же значение. В равновесных условиях температура пропорциональна средней кинетической энергии частиц тела.
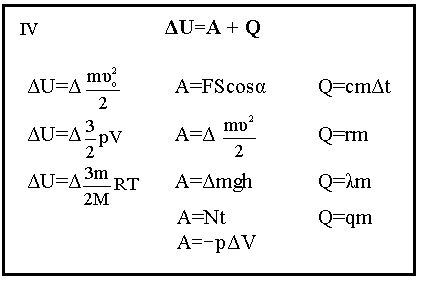
С макроскопических позиций понятие температуры связано со вторым началом термодинамики. Дело в том, что термометры (жидкостные, металлические, газовые) представляют собой макроскопические объекты, которые приводятся в соприкосновение с исследуемым телом. Между телом и термометром начинается теплообмен, который идет до тех пор, пока не сравняются температуры, при этом термометр и тело обмениваются некоторым количеством внутренней энергии. В этом случае температура указывает направление теплообмена. При равенстве температур тела находятся в термодинамическом равновесии, и температура выступает как величина, характеризующая состояние термодинамического равновесия макроскопической системы. Следует заметить, что при термодинамическом равновесии температура в любой части системы имеет одно и то же значение. В равновесных условиях температура пропорциональна средней кинетической энергии частиц тела.10. СТРУКТУРНО-ЛОГИЧЕСКИЙ БЛОК «ИЗМЕНЕНИЕ ВНУТРЕННЕЙ ЭНЕРГИИ ИДЕАЛЬНОГО ГАЗА».
1) 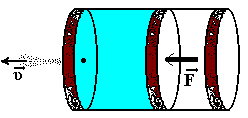 Газ вытекает адиабатически через малое отверстие из замкнутого отверстия в вакуумное пространство. Постоянное давление газа в сосуде поддерживается перемещением поршня. При этом температура газа в сосуде остаётся постоянной, а вне сосуда равна нулю. Оценить скорость газовой струи в вакууме. Температура газа в сосуде – Т, молярная масса – μ, молярная теплоёмкость при постоянном давлении – СР.
Газ вытекает адиабатически через малое отверстие из замкнутого отверстия в вакуумное пространство. Постоянное давление газа в сосуде поддерживается перемещением поршня. При этом температура газа в сосуде остаётся постоянной, а вне сосуда равна нулю. Оценить скорость газовой струи в вакууме. Температура газа в сосуде – Т, молярная масса – μ, молярная теплоёмкость при постоянном давлении – СР.
(О.Я. Савченко «Задачи по физике». Наука. 1988г.)
При адиабатном процессе нет теплопередачи. Q=0, поэтому первый закон термодинамики запишется так: ΔU=A. Работу можно представить как работу, совершённую над газом плюс кинетическая энергия вытекающего газа (работа по ускорению газа).
ΔU=A1+А2 или Δ 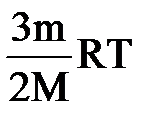 =-рΔV+
=-рΔV+ 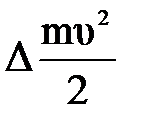 , рΔV=
, рΔV= 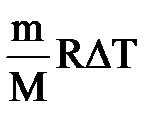 , ΔТ=Т
, ΔТ=Т 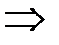
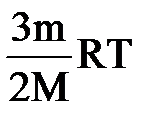 = -
= - 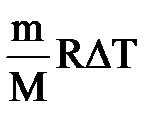 +
+ 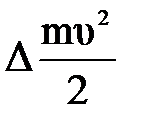 , откуда
, откуда 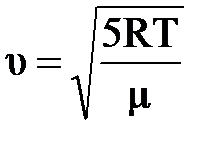 . Принимая во внимание, что СР=
. Принимая во внимание, что СР= 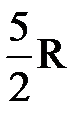 , получим
, получим 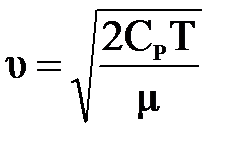 .
.
2) Определить максимальную скорость истечения газа из сопла ракеты, если тяга ракеты создаётся в результате реакции: 2Н2+О2=2Н2О + 483 кДж/моль.
(О.Я. Савченко «Задачи по физике». Наука. 1988г.)
Пусть начальная температура реагирующих веществ равна нулю, тогда при реакции изменение внутренней энергии на один моль воды равно 483/2 кДж/моль, а работа по ускорению одного моля газа равна А= 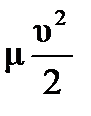 , отсюда ΔU=А , ΔU=
, отсюда ΔU=А , ΔU= 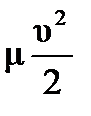
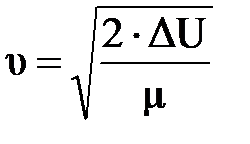
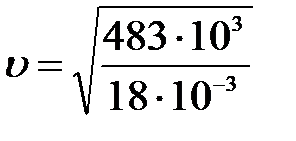 =5,18км/с
=5,18км/с
3) Теплоизолированный сосуд с азотом движется со скоростью υ=86м/с. Температура газа 0о С. Какова будет средняя энергия поступательного движения молекул газа, если сосуд остановить? Молекулы считать материальными точками. (И.В. Иродов «Сборник задач по общей физике». Наука.1972г.)
| Дано: Т1=273К μ=28х10-3кг/моль. υ=86м/с W=? | Запишем второй закон термодинамики: ΔU=A+Q, Q=0 ΔU= 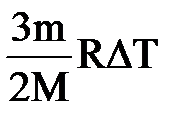 , А= , А= 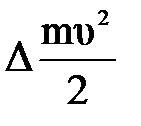  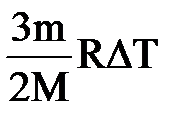 = = 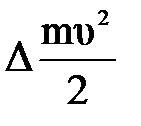 . R=NAk, отсюда . R=NAk, отсюда 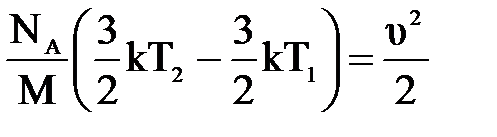 , или , или 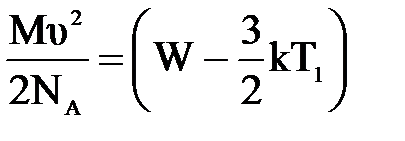 , поэтому , поэтому 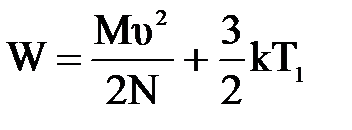 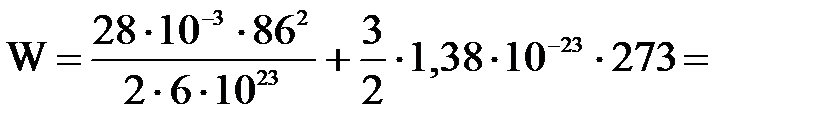 582,4х10-23Дж. 582,4х10-23Дж. |
| Ответ: Средняя энергия поступательного движения молекул равна 582х10-23Дж. |
4) В сосуде находится гелий, который изобарно расширяется. При этом к нему подводится количество теплоты, равное 15 кДж. На сколько изменится внутренняя энергия газа? Какова работа расширения?
(А.А. Пинский «Задачи по физике». Наука. 1977г.)
| Дано: Q=15000Дж ΔU=? | Запишем первый закон термодинамики: ΔU=A+Q. Подставим выражения для внутренней энергии и работы: 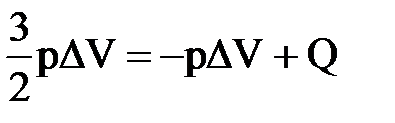 , или , или 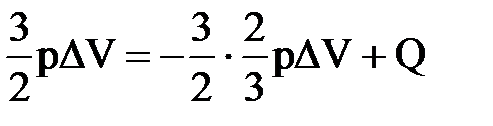 , поэтому ΔU=- , поэтому ΔU=- 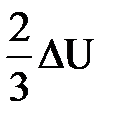 +Q, отсюда Q= +Q, отсюда Q= 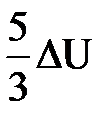 , а , а 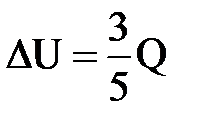 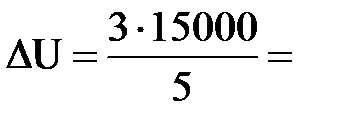 9кДж. А= 9кДж. А= 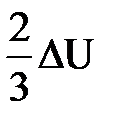 А= А= 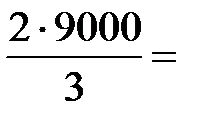 6кДж. 6кДж. |
| Ответ: Изменение внутренней энергии равно 9кДж, а работа по расширению газа равна 6кДж. |
ДОМАШНЕЕ ЗАДАНИЕ 9
4. В цилиндре под поршнем находится 1,25 кг воздуха. Для его нагревания на 4°С при постоянном давлении было затрачено 5 кДж теплоты. Определите изменение внутренней энергии воздуха (m = 0,029 кг/моль).
Дж
5. 0,02 кг углекислого газа нагревают при постоянном объеме. Определите изменение внутренней энергии газа при нагревании от 20 до 108°С (сv = 655 Дж/кг×К).
Дж
6. При изобарном расширении 0,04 кг кислорода его температура изменяется на 6°С. Величина работы, совершенная во время этого процесса, равна 250 Дж. Какое количество теплоты было передано газу и чему равно изменение его внутренней энергии (ср = 916 Дж/кг×К)?
Дж -30 Дж
7. 0,2 кг азота нагревают при постоянном давлении от 20 до 80°С. Какое количество теплоты поглощается при этом? Какую работу производит газ? (ср = 103 Дж/кг×К).
12×103 Дж 3,6×103 Дж
11. ПРИНЦИП ДЕЙСТВИЯ ТЕПЛОВОГО ДВИГАТЕЛЯ. К.П.Д. ТЕПЛОВОГО ДВИГАТЕЛЯ.
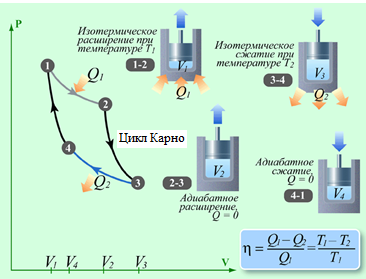
Тепловые машины играют исключительную роль в жизни человека. Они превращают внутреннюю энергию топлива в механическую энергию, электрическую. Тепловые двигатели преобразуют внутреннюю энергию топлива в механическую. Основная доля используемой энергии падает на внутреннюю энергию топлива (угля, нефти, газа, торфа). Рассмотрим принцип действия теплового двигателя. Несмотря на их различие в конструктивном плане, все тепловые двигатели решают одну задачу — превратить внутреннюю энергию топлива в механическую энергию по следующей схеме. Внутренняя энергия при сгорании топлива передается какому либо газу — рабочему телу. Раскалённый газ, как указано на диаграмме, расширяется и совершает работу (участок 1-2), приводя в действие какой-либо механизм (поршень, турбину). Потом газ охлаждают (участок 2-3). Холодный газ сжимают (участок 3-4). При этом часть полученной энергии расходуется на сжатие, но естественно в меньшем количестве, чем получили при расширении, т.к. обратный процесс идёт при более низком давлении. Сжатый газ снова нагревают (участок 4-1), и цикл завершается. В дальнейшем процессы повторяются, При каждом цикле машина дает некоторую полезную работу, определяемую площадью диаграммы 1-2-3-4. Работа теплового двигателя может быть описана различны 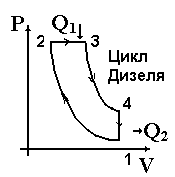 ми процессами. Если нагревание и охлаждение происходят при постоянном объёме (изохорный процесс), а расширение и сжатие – адиабатные процессы (процессы без теплообмена), то цикл называется – цикл Отто. Цикл, состоящий из 1-2 – адиабатное сжатие, 2-3 – изобарное нагревание, 3-4 – адиабатное расширение, 4-1 – изохорное охлаждение – называется циклом Дизеля. Цикл, состоящий из 1-2 – адиабатное сжатие, 2-3’ – изохорное нагревание, 3’-3 – изобарное нагревание, 3-4 – адиабатное рас
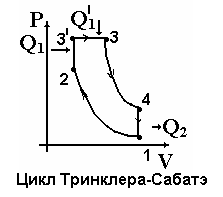
ми процессами. Если нагревание и охлаждение происходят при постоянном объёме (изохорный процесс), а расширение и сжатие – адиабатные процессы (процессы без теплообмена), то цикл называется – цикл Отто. Цикл, состоящий из 1-2 – адиабатное сжатие, 2-3 – изобарное нагревание, 3-4 – адиабатное расширение, 4-1 – изохорное охлаждение – называется циклом Дизеля. Цикл, состоящий из 1-2 – адиабатное сжатие, 2-3’ – изохорное нагревание, 3’-3 – изобарное нагревание, 3-4 – адиабатное рас 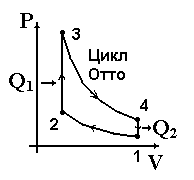 ширение, 4-1 – изохорное охлаждение, называется циклом Тринклера-Сабатэ.
ширение, 4-1 – изохорное охлаждение, называется циклом Тринклера-Сабатэ.
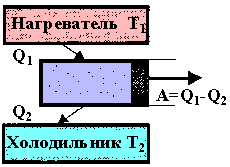 При каждом цикле машина дает некоторую полезную работу, определяемую площадью диаграммы 1-2-3-4. Существуют и другие циклы. Круговой процесс, в котором совершается положительная работа, называется прямым циклом. Он изображается в виде замкнутой кривой, проходимой рабочим телом по часовой стрелке. Обратным циклом называется круговой процесс, в котором работа, совершаемая системой, отрицательна. Как правило, реальные машины работают по разомкнутому циклу, т.е. отработанный газ отводится в холодильник и заменяется новым, что значительно упрощает конструкцию машины, но термодинамика процессов при этом существенно не изменяется. Любая тепловая машина состоит из нагревателя, рабочей части и холодильника. Нагреватель представляет собой либо котёл, либо камеру сгорания, где сжигается топливо. В нагревателе рабочее тело получает энергию. Рабочая часть машины представляет собой цилиндр с поршнем, турбину или какое-либо другое устройство, где газ, расширяясь, совершает работу. Холодильник представляет собой либо специально изготовленную камеру, либо просто атмосферу, куда выбрасывается отработанный газ.
При каждом цикле машина дает некоторую полезную работу, определяемую площадью диаграммы 1-2-3-4. Существуют и другие циклы. Круговой процесс, в котором совершается положительная работа, называется прямым циклом. Он изображается в виде замкнутой кривой, проходимой рабочим телом по часовой стрелке. Обратным циклом называется круговой процесс, в котором работа, совершаемая системой, отрицательна. Как правило, реальные машины работают по разомкнутому циклу, т.е. отработанный газ отводится в холодильник и заменяется новым, что значительно упрощает конструкцию машины, но термодинамика процессов при этом существенно не изменяется. Любая тепловая машина состоит из нагревателя, рабочей части и холодильника. Нагреватель представляет собой либо котёл, либо камеру сгорания, где сжигается топливо. В нагревателе рабочее тело получает энергию. Рабочая часть машины представляет собой цилиндр с поршнем, турбину или какое-либо другое устройство, где газ, расширяясь, совершает работу. Холодильник представляет собой либо специально изготовленную камеру, либо просто атмосферу, куда выбрасывается отработанный газ.
Пусть рабочее тело берёт от нагревателя некоторое количество тепла Q1, часть его превращается в работу, а оставшуюся часть Q2 отдаёт холодильнику Q1=A+Q2. Коэффициент полезного действия 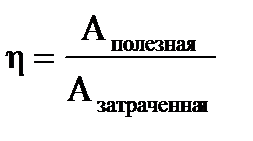 , или
, или 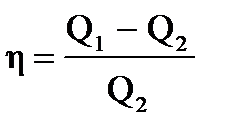 . При этом не учитываются потери на трение в движущихся частях машины. Французский ученый Карно доказал, что К.П.Д. идеализированной машины, без учета каких либо потерь, не может превышать следующей величины,
. При этом не учитываются потери на трение в движущихся частях машины. Французский ученый Карно доказал, что К.П.Д. идеализированной машины, без учета каких либо потерь, не может превышать следующей величины,
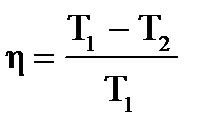 где Т1 — температура нагревателя, а T2 — температура холодильника.
где Т1 — температура нагревателя, а T2 — температура холодильника.
КПД любой реальной тепловой машины меньше идеального КПД и практически не превышает 50%. У мощных тепловых электростанций, например, КПД составляет 35—40%, у двигателей внутреннего сгорания 40—50%.
В конструктивном отношении тепловые двигатели делятся на:
| Двигатели внешнего сгорания: | Двигатели внутреннего сгорания: | ||
| Поршневые | Турбины | Поршневые | Турбины |
| Паровые двигатели | Паровые турбины | Карбюраторные | Газотурбинные двигатели |
| Дизельные | Реактивные двигатели |
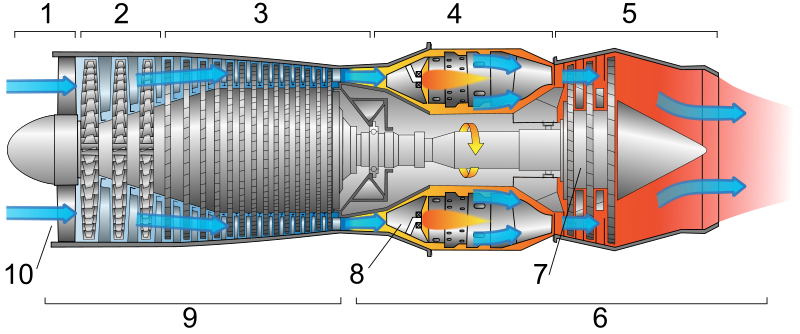
Широкое распространение получили двигатели внутреннего сгорания, турбины и реактивные двигатели. Двигатели внутреннего сгорания в основном используются в автомобилестроении, реактивные двигатели в авиации, турбины на электростанциях.
Пример: Температура нагревателя идеальной тепловой машины 117оС, а холодильника 27оС. Количество теплоты, получаемой машиной от нагревателя за 1с, равно 60кДж. Вычислить КПД машины, количество теплоты, отдаваемое холодильнику за 1с, и мощность машины.
| Дано: Т1=117+273К Т2 =27+273К Q1=60000Дж. t=1c η=? Q2=? N=? | КПД находится по формулам 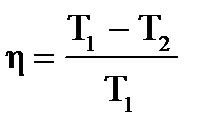 и и 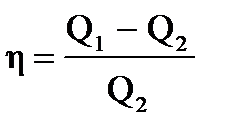 , отсюда η= , отсюда η= 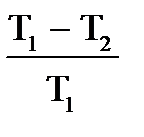 = = 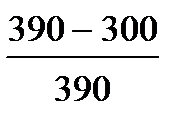 =0,23 =0,23 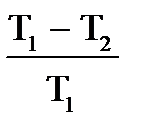 = = 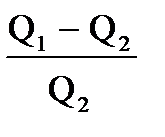 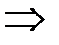 Q2= Q2= 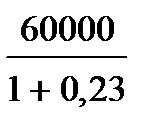 =48780Дж. N= =48780Дж. N= 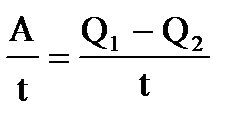 N= N= 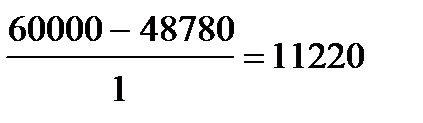 Вт. Вт. |
| Ответ: КПД машины равен 0,23 или 23%, количество теплоты, переданное холодильнику 48780Дж, мощность тепловой машины 11220Вт. |
Пример: В идеальной тепловой машине за счёт каждого килоджоуля энергии, получаемой от нагревателя, совершается работа 300Дж. Определить КПД машины и температуру нагревателя, если температура холодильника 280К
| Дано: А=300Дж Q1=1000Дж Т2=280К η=? Т1=? | Коэффициент полезного действия определим по формуле 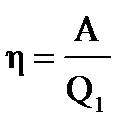 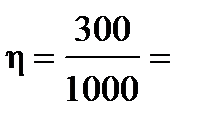 0,3 или 30% η= 0,3 или 30% η= 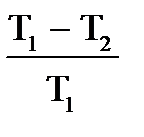  Т1= Т1= 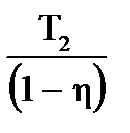 Т1= Т1= 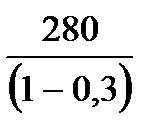 = 400К = 400К |
| Ответ: КПД машины 30%. Температура нагревателя 400К. |
Вопросы:
1. Что называется тепловой машиной?
2. Что называется тепловым двигателем?
3. По каким циклам может работать двигатель?
4. Как найти КПД идеальной тепловой машины?
5. Как найти КПД реальной тепловой машины?
6. Как классифицируются тепловые двигатели?
| Рисунок 4 Реактивный двигатель |
ДОМАШНЕЕ ЗАДАНИЕ 10.
1. Давление газа при температуре 300 К составляет 3,6 МПа. Найти концентрацию молекул.
2. При температуре 400 К, скорость молекул 200 м/с. Определить массу молекул.
3. Масса молекулы водяного пара 3,0х10-26 кг. С какой скоростью движутся молекулы при температуре 300 К?
4. Найти внутреннюю энергию 6 кг водяного пара при Т=1000 К.
5. Давление газа в баллоне 50 МПа, а объем баллона 0,2 м3. Определить внутреннюю энергию газа.
6. Скорость движения молекул газа 600 м/с. Определить температуру газа.
7. Начертить график Wк =f(Т) для молекул кислорода и водорода.
8. В тепловом процессе температура газа понизилась от 1200 К до 600 К. Определить КПД процесса.
9. Конструктор предложил тепловую машину, КПД которой 86%. При проверке оказалось, что температура нагревателя 1300 К, а температура холодильника 600 К. Дать рецензию на машину.
10. Начертить изопроцессы в координатах p,V.
11. Начертить изопроцессы в координатах V,T.
12. Определить массу метана СН4 в цистерне объемом 60 м3 при температуре 300 К. Давление газа 5,0 МПа.
13.Сколько молекул воздуха содержится в комнате, объем которой 200 м, при температуре 290 К и давлении 102 кПа. Масса моля воздуха 29х10-3 кг.
14. Масса водорода 0,02 кг, а занимаемый им объем - 0,1 м3, Давление газа составляло 100 кПа. Газ нагрели до температуры 300 К. Определить изменение внутренней энергии газа.
15. В двух баллонах при одинаковой температуре хранятся кислород и углекислый газ. Сравнить давление газа.
16. Найти изменение внутренней энергии одного моля газа при изменении температуры на 1 К.
17. Средняя кинетическая энергия молекул кислорода при 0 °С составляет 5,6х10-21Дж. Найти среднюю кинетическую энергию молекул водорода

