Термодинамический цикл
КОНТРОЛЬНО-КУРСОВАЙ РАБОТА
по дисциплине
ТЕРМОДИНАМИКА
Направление подготовки: Проектирование
авиационных и ракетных двигателей
Профиль подготовки: Проектирование ракетных двигателей твердого топлива
Форма обучения очная
Выполнил
Студент гр:312231 Семин О.В.
Проверил
Евланова О.А.
Тула 2015 г.
Часть 1
Газовые смеси и теплоемкости
Цель работы: определение основных параметров газовых смесей и теплоемкостей.
Исходные данные
Массовые доли в процентном соотношении состава компонентов смеси gi%
| СO2 | N2 | H2O | O2 |
Давление смеси pсм=0,9 бар=90 кПа
Объем смеси Vсм =10 м3
Температура смеси tсм =2000 °С=2273°К
Температура для определения истинной теплоемкости смеси t=2000°С=2273°К Интервал температур для определения средней теплоемкости смеси
t1 - t2=900-600°С=1173-873°К
Масса 1кмоль mi, кг/кмоль
| СO2 | N2 | H2O | O2 |
Универсальная газовая постоянная mR=8,3144 кДж/кмольК
Определить:
1. Состав смеси (если по условию задачи задан состав смеси в объемных долях ri, следует определить дополнительно состав смеси в массовых долях gi).
2. Газовые постоянные компонентов Ri и смеси Rсм, кДж/ кг К.
3. Среднюю молярную массу смеси mcм через объемные и массовые доли.
4. Парциальные давления компонентов pi через объемные и массовые доли.
5. Массу смеси mсм , кг и компонентов mi , кг.
6. Парциальные объемы Vi, м3/кг и плотности ri, кг/м3.
7. Истинные молярную mс, кДж/кмольК, объемную с/, кДж/м3К и массовую с, кДж/кгК теплоемкости при p=const и v=const для заданной температуры смеси t, С.
8. Средние молярную mсср, объемную с/ср и массовую сср теплоемкости для заданного интервала температур.
9. Количество теплоты, необходимое на нагревание (охлаждение) в интервале температур при p=const: количества вещества 2 моль, 5 м3 и 7 кг смеси.
Ход работы:
| формула | расчет | Единицы измерения | |||
| СО2 | N2 | H2O | O2 | ||
| ri= gi*mcм/mi | 0,14*28.64/44= =0,091 | 0.76*28.64/28= =0,777 | 0.06*28.64/18= =0,095 | 0.04*28.64/32= =0,036 | - |
| Ri=mR/mi | 8,314/44= =0,19 | 8,314/28= =0,297 | 8,314/18= =0,462 | 8,314/32= =0,26 | кДж/ кг К. |
| Rсм=Ʃgi* Ri | 0.14*0.19+0.76*0.269+0.06*0.462+0.04*0.26=0,290239 | кДж/ кг К | |||
| mcм= =mR/Ʃ(gi*Ri) | 8,314/(0.14*0.189+0.76*0.269+0.06*0.462+0.04*0.26)= 28,65 | кг/кмоль | |||
| pi=pсм*gi* *Ri/Rсм | 90*0.14*0.189/ /0.29= =8.203 | 90*0.76*0.297/ /0.29= =69.98 | 90*0.06*0.462/ /0.29= =8.59 | 90*0.04*0.26/ /0.29= =3.22 | кПа |
| mi=pсм*Vсм* *ri/(Ri*T) | 90*10*0.0911/ /(0.189*2273)= =0.19 | 90*10*0.778/ /(0.297*2273)= =1.037 | 90*10*0.096/ /(0.462*2273)= =0.086 | 90*10*0.035/ /(0.26*2273)= =0.0546 | кг |
| mсм=pсм*Vсм/ /(Rсм*T) | 90*10/(0,29*2273)=1,36 | кг | |||
| Vi= ri* Vсм | 0.091*10= =0,911 | 0.777*10= =7,78 | 0.095*10= =0,955 | 0.036*10= =0,358 | м3 |
| ri= mi/Vi | 0,19/0,911=0,21 | 1,037/7,776= =0,133 | 0,0857/0,955= =0,0857 | 0,0546/0,358= =0,152 | кг/м3 |
| mсср|t2 и-mсср|t1 табличные значения | |||||
| mсср= =(mсср|t2*t2- -mсср|t1*t1)/ /(t2-t1) | (48.62*1273- -45.76*873)/ /(1273-873)= =54,86 | (30,93*1273- -30,05*873)/ /(1273-873)= =32,85 | (38,01*1273- -36,2*873)/ /(1273-873)= =41,96 | (32,82*1273- -31,77*873)/ /(1273-873)= =35,11 | кДж/ кмоль К |
| mссрcм= =Ʃ(ri*mсср) | 54,86*0,091+32,85*0,777+41,96*0,095+35,11*0,036=35,77 | кДж/ кмоль К | |||
| сср=mсср/mi | 54,86/44=1,25 | 32,85/28=1,17 | 41,96/18=2,33 | 35,11/32=1,1 | кДж/кг K |
| ссрcм= =Ʃ(gi*сср ) | 1,25*0,14+1,17*0.76+2,33*0.06+1,1*0.04=1,248 | кДж/кг K | |||
| с/ср=mсср/22,4 | 54,86/22,4=2,45 | 32,85/22,4=1,47 | 41,96/22,4=1,87 | 35,11/22,4=1,57 | кДж/ м3 K |
| c /срcм= =Ʃ(ri*c /ср) | 2,45*0,091+1,47*0,777+1,87*0,095+1,57*0,036=1,59931 | кДж/ м3 K | |||
| mс=табличное значение | 60,66 | 37,2 | 52,94 | 38,41 | кДж/ кмоль К |
| mсcм=Ʃ(ri*mс) | 60,66*0,091+37,2*0,777+52,94*0,095+38,41*0,036=40,84 | кДж/ кмоль К | |||
| с=mс/mi | 60,66/44=1,38 | 37,2/28=1,33 | 52,94/18=2,94 | 38,41/32=1,2 | кДж/кг K |
| cсм=Ʃ(gi*с) | 1,38*0,14+1,33*0.76+2,94*0.06+1,2*0.04=1,43 | кДж/кг K | |||
| с/=mс/22,4 | 60,66/22,4=2,71 | 37,2/22,4=1,66 | 52,94/22,4=2,36 | 38,41/22,4=1,71 | кДж/ м3 K |
| c /cм=Ʃ(ri*c /) | 2,71*0,091+1,66*0,777+2,36*0,095+1,71*0,036=1,82 | кДж/ м3 K |
Ответы на задание 1 части работы
| Параметры смеси | Компоненты смеси | ||||||
| СO2 | H2 | СO | N2 | H2O | SO2 | O2 | |
| ri | 0,091 | - | - | 0,78 | 0,09 | - | 0,036 |
| gi | 0,14 | - | - | 0,76 | 0,06 | - | 0,04 |
| Ri | 0,189 | - | - | 0,3 | 0,46 | - | 0,26 |
| pi | 8,2 | - | - | 8,59 | - | 3,22 | |
| mi | 0,19 | - | - | 1,04 | 0,082 | - | 0,055 |
| Vi | 0,91 | - | - | 7,78 | 0,95 | - | 0,36 |
| ri | 0,21 | - | - | 0,13 | 0,086 | - | 0,15 |
Часть 2
Термодинамический цикл
Цель работы: анализ термодинамических циклов тепловых двигателей и определение основных параметров циклов.
Исходные данные
Задан цикл, состоящий из четырех последовательно осуществляемых процессов: 1)изотерм, 2)изохор, 3)изотерм, 4)изохор;
рабочее тело – 1 кг сухого воздуха;
теплоемкость Сp = 1,025 кДж/кгК;
газовая постоянная R = 0,287 кДж/кгК.
Заданные параметры в основных точках:P1=0,3 МПа; Т1=300 К;
P2=0,8 МПа; Т3=473 К.
Определить:
1. Параметры p,v и T для основных точек цикла (точек пересечения процессов).
2. Показатель политропы n, теплоемкость c, изменения внутренней энергии  u, энтальпии
u, энтальпии  H, энтропии
H, энтропии  s, количество теплоты q, работу L, располагаемую работу L0 для каждого термодинамического процесса.
s, количество теплоты q, работу L, располагаемую работу L0 для каждого термодинамического процесса.
3. Количество теплоты q1, подведенное за цикл, и q2, отведенное за цикл, работу цикла Lц, располагаемую работу цикла L0ц, термический к.п.д. цикла ht .
Ход работы:
1. Параметры p,v и T для основных точек цикла
P1=0,3 МПа –задано исходными данными
Т1=300 К –задано исходными данными
V1=mRT1/P1=1*300*286/300 000=0,29 м3
Изотермический процесс
P2=0,8 МПа –задано исходными данными
T2=T1=300 K-при изотерме T=const
V2=mRT2/P2=1*300*286/800 000=0,12 м3
Изохорный процесс
T3=473 K–задано исходными данными
V3=V2=0,12м3-при изохоре V=const
P3= mRT3/V3=1*286*473/0.12=1.13 МПа
Изотермический процесс
T4=T3=473 K-при изотерме T=const
V4=V1=0,29 м3-так как термодинамический цикл замкнут изахорным процессом V=const
P4= mRT4/V4=1*286*473/0.29=0,47 МПа
2. Показатель политропы n, теплоемкость c, изменения внутренней энергии  u, энтальпии
u, энтальпии  H, энтропии
H, энтропии  s, количество теплоты q, работу L, располагаемую работу L0 для каждого термодинамического процесса.
s, количество теплоты q, работу L, располагаемую работу L0 для каждого термодинамического процесса.
Процесс№ 1-2
Показатель политропы n
n=1-изотерма
теплоемкость cv
cv=cp-R=1,025-0,287=0,738 кДж/кг К
изменение внутренней энергии  u
u
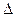 u= 0-для изотермического процесса
u= 0-для изотермического процесса
Изменение энтальпии  H
H
 H=0-для изотермического процесса
H=0-для изотермического процесса
Изменение энтропии  s
s
 s= cp*ln*T2/T1 + R ln p2/p1=0+0,287*ln(0,8/0,3)=0,281 кДж/кг -для изотермического процесса
s= cp*ln*T2/T1 + R ln p2/p1=0+0,287*ln(0,8/0,3)=0,281 кДж/кг -для изотермического процесса
количество теплоты q
q=2,3*p1*v1**1g(p1/p2)=2.3*0.3*0.29*lg(0.3/0.8)=-85.2кДж
-для изотермического процесса
работа L
L=q=-85.2кДж -для изотермического процесса
располагаемая работа L0
L0=L=-85.2кДж -для изотермического процесса
Процесс№ 2-3
Показатель политропы n
n=∞-изохора
теплоемкость cv
cv=cp-R=1,025-0,287=0,738 кДж/кг К
изменение внутренней энергии  u
u
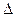 u = cv (Т3-Т2)= 0,738*(473-300)=127,7 кДж/кг –для изохорного процесса
u = cv (Т3-Т2)= 0,738*(473-300)=127,7 кДж/кг –для изохорного процесса
Изменение энтальпии  H
H
 H= cp*(T3–T2)=1,025*(473-300)=177,3 кДж/кг–для изохорного процесса
H= cp*(T3–T2)=1,025*(473-300)=177,3 кДж/кг–для изохорного процесса
Изменение энтропии  s
s
 s=cv*ln*(T3/T2)= 0,738 *ln(473/300)=0,336 кДж/кг–для изохорного процесса
s=cv*ln*(T3/T2)= 0,738 *ln(473/300)=0,336 кДж/кг–для изохорного процесса
количество теплоты q
q= 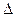 u=127,7 кДж–для изохорного процесса
u=127,7 кДж–для изохорного процесса
работа L
L=0–для изохорного процесса
располагаемая работа L0
L0= -v(p3 – p2)= 0,12*(1.13-0.8)=-39.6 кДж
Процесс№ 3-4
Показатель политропы n
n=1-изотерма
теплоемкость cv
cv=cp-R=1,025-0,287=0,738 кДж/кг К
изменение внутренней энергии  u
u
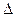 u= 0-для изотермического процесса
u= 0-для изотермического процесса
Изменение энтальпии  H
H
 H=0-для изотермического процесса
H=0-для изотермического процесса
Изменение энтропии  s
s
 s= cp*ln*T4/T3 + R ln p4/p3=0+0,287*ln(0,47/1.13)=-0,252 кДж/кг -для изотермического процесса
s= cp*ln*T4/T3 + R ln p4/p3=0+0,287*ln(0,47/1.13)=-0,252 кДж/кг -для изотермического процесса
количество теплоты q
q=2,3*p3*v3**1g(p3/p4)=2.3*1.13*0.12*lg(1.13/0.47)=0,119кДж
-для изотермического процесса
работа L
L=q=0,119кДж -для изотермического процесса
располагаемая работа L0
L0=L=0,119кДж -для изотермического процесса
Процесс№ 4-1
Показатель политропы n
n=∞-изохора
теплоемкость cv
cv=cp-R=1,025-0,287=0,738 кДж/кг К
изменение внутренней энергии  u
u
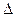 u = cv (Т1-Т4)= 0,738*(300-473)=-127,7 кДж/кг –для изохорного процесса
u = cv (Т1-Т4)= 0,738*(300-473)=-127,7 кДж/кг –для изохорного процесса
Изменение энтальпии  H
H
 H= cp*(T1–T4)=1,025*(300-473)=-177,3 кДж/кг–для изохорного процесса
H= cp*(T1–T4)=1,025*(300-473)=-177,3 кДж/кг–для изохорного процесса
Изменение энтропии  s
s
 s=cv*ln(T1/T4)= 0,738 *ln(300/473)=-0,336 кДж/кг–для изохорного процесса
s=cv*ln(T1/T4)= 0,738 *ln(300/473)=-0,336 кДж/кг–для изохорного процесса
количество теплоты q
q= 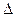 u=-127,7 кДж–для изохорного процесса
u=-127,7 кДж–для изохорного процесса
работа L
L=0–для изохорного процесса
располагаемая работа L0
L0= -v(p1 – p4)= 0,12*(1.13-0.8)=0,0493 кДж
3. Количество теплоты q1, подведенное за цикл, и q2, отведенное за цикл, работу цикла Lц, располагаемую работу цикла L0ц, термический к.п.д. цикла ht .
q1=q2-3+q3-4=127,7+0,119=127.82 кДж
q2=-q1-2-q4-1=-(-127.7)-(-85.2)=212.9 кДж
Lц=ƩLi=0+0,119-85.2=-85.08 кДж
L0ц= ƩL0i=0,0493+0,119-39.6-85.2=-124.6 кДж
ht=1- T2 / T1=1-300/473=0.37=37%
Результаты расчетов представить в виде расчетных формул и таблицы 7.
Таблица 7
| Про цесс | n | с, кДж/кгК |  u, кДж/кг u, кДж/кг |  i кДж/кг i кДж/кг |  s, кДж/кгК s, кДж/кгК | q, кДж/кг | L, кДж/кг | L0, кДж/кг |
| 1-2 | ||||||||
| 2-3 | ||||||||
| 3-4 | ||||||||
| 4-1 |
Таблица 1
| № задачи | |||||||||||
| СO2 | H2 | СO | N2 | H2O | SO2 | O2 | |||||
| - | - | - | 0,95 | 200-1000 | |||||||
| - | - | - | 1,0 | 300-1000 | |||||||
| - | - | - | 0,9 | 100-300 | |||||||
| - | - | - | 1,05 | 600-200 | |||||||
| - | - | - | 1,05 | 1000-100 | |||||||
| - | - | - | 0,85 | 900-200 | |||||||
| - | - | - | 0,7 | 700-500 | |||||||
| - | - | - | - | 0,95 | 500-200 | ||||||
| - | - | - | 1,0 | 800-300 | |||||||
| - | - | - | 1,05 | 600-100 | |||||||
| - | - | - | 1,2 | 850-350 | |||||||
| - | - | - | 1,0 | 350-750 | |||||||
| - | - | - | 0,9 | 900-600 | |||||||
| - | - | - | 1,0 | 450-300 | |||||||
| - | - | - | 1,05 | 300-150 | |||||||
| - | - | - | 1,05 | 800-300 | |||||||
| - | - | - | 0,9 | 400-900 | |||||||
| - | - | - | 0,95 | 800-300 | |||||||
| - | - | - | 1,15 | 650-150 | |||||||
| - | - | - | 0,85 | 150-1200 | |||||||
| - | - | - | 1,0 | 300-800 | |||||||
| - | - | - | 1,0 | 1200-1000 | |||||||
| - | - | - | 0,9 | 400-900 |
В задачах №1-10 заданы объемные, в остальных задачах – массовые доли компонентов.
Таблица 6
| № задачи | Заданные параметры в основных точках (p – в МПа, v – в м3/кг, Т – в К) | Тип процесса и показатель политропы | ||||||
| p2=0,1 | Т2=338 | Т3=273 | Т4=433 | n = 1,3 | изобар. | адиабат. | изохор. | |
| p1=0,8 | v1=0,12 | p2=2,0 | p3=1,2 | адиабат. | изотерм. | адиабат. | изохор. | |
| p1=1,3 | T1=573 | p2=0,5 | Т3=290 | изотерм. | адиабат. | изотерм. | адиабат. | |
| p1=0,2 | v1=0,45 | p2=1,2 | Т3=573 | адиабат. | изохор. | адиабат. | изобар. | |
| p1=0,1 | T1=273 | p2=0,5 | T3=473 | n = 1,3 | изобар. | n =1,3 | изобар. | |
| p1=0,09 | T1=303 | p2=0,4 | Т3=473 | n = 1,2 | изобар. | n = 1,2 | изохор. | |
| p1=0,16 | v1=0,5 | Т2=423 | p3=2,5 | n = 1,2 | изохор. | n = 1,2 | изобар. | |
| p1=0,18 | Т1=303 | v2=0,1 | p3=0,3 | n = 1,1 | изотерм. | n = 1,1 | изохор. | |
| p1 =0,3 | v1=0,3 | p2=2,0 | Т3=573 | n = 1,3 | изобар. | n = 1,3 | изобар. | |
| p1=2,0 | Т1=473 | Т2=623 | v3=0,12 | изобар. | адиабат. | изохор. | изотерм. | |
| p1=0,2 | Т1=323 | p2=2,0 | Т3=473 | изотерм. | изобар. | изотерм. | изобар. | |
| p1=0,4 | Т1=373 | p2=1,6 | p3=0,6 | адиабат. | изотерм. | адиабат. | изобар. | |
| p1=0,3 | Т1=300 | p2=0,8 | Т3=473 | изотерм. | изохор. | изотерм. | изохор. | |
| p1=1,2 | Т1=373 | p2=3,0 | Т3=473 | изотерм. | изобар. | изотерм. | изобар. | |
| p1=5,0 | Т1=573 | p2=1,8 | v3=0,2 | изотерм. | адиабат. | изохор. | адиабат. | |
| p1=0,7 | v1=0,12 | p1=2,0 | Т3=473 | адиабат. | изобар. | адиабат. | изотерм. | |
| p1=0,3 | Т1=303 | p2=0,6 | Т3=523 | адиабат. | изохор. | адиабат. | изотерм. | |
| p1=0,12 | v1=0,7 | v2=0,2 | Т3=423 | изотерм. | изобар. | изотерм. | изобар. | |
| p1=0,4 | v1=0,3 | p2=1,0 | Т3=573 | изотерм. | изобар. | адиабат. | изобар. | |
| p1=0,7 | Т1=473 | Т2=573 | v3=0,4 | изобар. | изотерм. | изохор. | адиабат. | |
| p1=0,3 | Т1=298 | p2=1,0 | Т3=573 | адиабат. | изобар. | изотерм. | изобар. | |
| p1=0,3 | v1=0,3 | p2=1,0 | T3=473 | адиабат. | изохор. | изотерм. | изобар. | |
| p1=1,0 | Т1=523 | Т2=573 | p3=0,6 | изобар. | адиабат. | изобар. | изохор. |
Таблица 2. Физические постоянные некоторых газов
| Газ | Химическая формула | Масса 1кмоль, кг/кмоль | Газовая постоянная R, Дж/кг град | Плотность газа при н.у., кг/м3 |
| Кислород | О2 | 259,8 | 1,429 | |
| Водород | Н2 | 2,016 | 4124,3 | 0,09 |
| Азот | N2 | 28,02 | 296,8 | 1,25 |
| Окись углерода | СО | 296,8 | 1,25 | |
| Воздух | - | 28,96 | 1,293 | |
| Углекислый газ | СО2 | 189,9 | 1,977 | |
| Водяной пар | Н2О | 18,016 | 461,6 | 0,804 |
| Гелий | Не | 4,003 | 2077,2 | 0,178 |
| Аммиак | NН3 | 17,031 | 488,2 | 0,771 |
Таблица 3. Истинная молярная теплоемкость различных газов
при р=const (μсp , кДж/ кмоль К)
| T, С | О2 | N2 (атм.) | Н2 | СО | СО2 | SO2 | Н2О | Воздух |
| 29,278 | 29,022 | 28,621 | 29,127 | 35,865 | 38,859 | 33,503 | 29,077 | |
| 29,881 | 29,106 | 29,131 | 29,265 | 40,211 | 42,418 | 34,060 | 29,269 | |
| 30,819 | 29,378 | 29,244 | 29,650 | 43,695 | 45,558 | 34,968 | 29,680 | |
| 31,836 | 29,816 | 29,303 | 30,258 | 46,522 | 48,238 | 36,040 | 30,270 | |
| 32,762 | 30,471 | 29,399 | 30,978 | 48,866 | 50,248 | 37,196 | 30,953 | |
| 33,553 | 31,137 | 29,563 | 31,711 | 50,822 | 51,714 | 38,411 | 31,644 | |
| 34,206 | 31,799 | 29,797 | 32,406 | 52,459 | 52,886 | 39,667 | 32,305 | |
| 34,751 | 32,414 | 30,103 | 33,030 | 53,833 | 53,766 | 40,956 | 32,904 | |
| 35,207 | 32,967 | 30,475 | 33,578 | 54,984 | 54,436 | 42,255 | 33,436 | |
| 35,558 | 33,461 | 30,873 | 34,060 | 55,960 | 55,022 | 43,519 | 33,907 | |
| 35,919 | 33,897 | 31,288 | 34,474 | 56,781 | 55,441 | 44,729 | 34,319 | |
| 36,221 | 34,278 | 31,727 | 34,830 | 57,480 | 55,776 | 45,864 | 34,684 | |
| 36,493 | 34,613 | 32,159 | 35,144 | 58,079 | 56,069 | 46,919 | 35,006 | |
| 36,756 | 34,906 | 32,594 | 35,417 | 58,594 | - | 47,903 | 35,295 | |
| 37,004 | 35,161 | 33,005 | 35,651 | 59,038 | - | 48,808 | 35,551 | |
| 37,246 | 35,387 | 33,398 | 35,860 | 59,499 | - | 49,645 | 35,777 | |
| 37,485 | 35,584 | 33,767 | 36,045 | 59,745 | - | 50,416 | 35,982 | |
| 37,720 | 35,764 | 34,118 | 36,208 | 60,030 | - | 51,140 | 36,174 | |
| 37,950 | 35,923 | 34,449 | 36,355 | 60,277 | - | 51,789 | 36,350 | |
| 38,180 | 36,070 | 34,767 | 36,484 | 60,486 | - | 52,384 | 36,514 | |
| 38,411 | 37,195 | 35,061 | 36,602 | 60,662 | - | 52,937 | 36,660 | |
| 38,641 | 36,313 | 35,337 | 36,710 | 60,935 | - | 53,456 | 36,803 | |
| 38,863 | 36,422 | 35,609 | 36,807 | 60,926 | - | 53,937 | 36,932 | |
| 39,085 | 36,518 | 35,856 | 36,899 | 61,014 | - | 54,377 | 37,058 | |
| 39,298 | 36,631 | 36,095 | 36,983 | 61,069 | - | 54,787 | 37,175 | |
| 39,508 | 36,694 | 36,321 | 36,058 | 61,094 | - | 55,168 | 37,284 |
Таблица 4. Средняя молярная теплоемкость различных газов
при р = const (μсp , кДж/ кмоль К)
| T, С | О2 | N2 (атм.) | Н2 | СО | СО2 | SO2 | Н2О | Воздух |
| 29,278 | 29,022 | 28,621 | 29,127 | 35,865 | 38,859 | 33,503 | 29,077 | |
| 29,542 | 29,052 | 28,939 | 29,181 | 38,117 | 40,659 | 33,746 | 29,156 | |
| 29,935 | 29,135 | 29,077 | 29,307 | 40,065 | 42,334 | 34,123 | 29,303 | |
| 30,404 | 29,290 | 29,127 | 29,521 | 41,760 | 43,883 | 34,579 | 29,525 | |
| 30,882 | 29,504 | 29,109 | 29,793 | 43,255 | 45,223 | 35,094 | 29,793 | |
| 31,338 | 29,768 | 29,253 | 30,103 | 44,579 | 46,396 | 35,634 | 30,099 | |
| 31,765 | 30,048 | 29,320 | 30,429 | 45,759 | 47,359 | 36,200 | 30,408 | |
| 32,155 | 30,346 | 29,412 | 30,756 | 46,819 | 48,238 | 36,794 | 30,727 | |
| 32,506 | 30,639 | 29,521 | 31,074 | 47,769 | 48,950 | 37,397 | 31,032 | |
| 32,829 | 30,928 | 29,650 | 31,380 | 48,624 | 49,620 | 38,013 | 31,325 | |
| 33,122 | 31,200 | 29,793 | 31,669 | 49,398 | 50,165 | 38,624 | 31,602 | |
| 33,390 | 31,459 | 29,948 | 31,941 | 50,106 | 50,667 | 39,231 | 31,866 | |
| 33,637 | 31,711 | 30,111 | 32,196 | 50,747 | 51,086 | 39,830 | 32,113 | |
| 33,867 | 31,945 | 30,291 | 32,431 | 51,329 | - | 40,412 | 32,347 | |
| 34,081 | 32,167 | 30,471 | 32,657 | 51,865 | - | 40,482 | 32,569 | |
| 34,286 | 32,376 | 30,651 | 32,862 | 52,355 | - | 41,530 | 32,778 | |
| 34,479 | 32,569 | 30,836 | 33,055 | 52,807 | - | 42,062 | 32,971 | |
| 34,663 | 32,753 | 31,016 | 33,235 | 53,226 | - | 42,581 | 33,155 | |
| 34,839 | 32,921 | 31,196 | 33,407 | 53,611 | - | 43,075 | 33,323 | |
| 35,010 | 33,084 | 31,376 | 33,566 | 53,967 | - | 43,544 | 33,486 | |
| 35,174 | 33,235 | 31,552 | 33,712 | 54,298 | - | 44,001 | 33,645 | |
| 35,333 | 33,381 | 31,727 | 33,855 | 54,603 | - | 44,399 | 33,792 | |
| 35,488 | 33,520 | 31,895 | 33,984 | 54,888 | - | 44,856 | 33,930 | |
| 35,638 | 33,645 | 32,062 | 34,110 | 55,152 | - | 45,261 | 34,064 | |
| 35,789 | 33,683 | 32,226 | 34,227 | 55,399 | - | 45,651 | 34,190 | |
| 35,932 | 33,880 | 32,389 | 34,340 | 55,624 | - | 46,023 | 34,311 |
