Основное уравнение МКТ
ФИЗИКА И ТЕРМОДИНАМИКА»
для студентов специальности
270205 “Автомобильные дороги и аэродромы”
очной и заочной форм обучения
Тюмень, 2009
УДК 539.19+536.7
В-27
Величко Т.И. Методические указания по курсу общей физики, раздел «Молекулярная физика и термодинамика», для студентов специальности 270205 «Автомобильные дороги и аэродромы» очной и заочной форм обучения. - Тюмень: РИО ГОУ ВПО ТюмГАСУ, 2009. – 16 с.
Методические указания представляют собой краткое содержание лекций по общей физике, раздел «Молекулярная физика и термодинамика».
Методические указания могут использоваться как справочное пособие при проведении практических и лабораторных занятий, при выполнении контрольных работ.
Рецензент: Михеев В.А.
Тираж 100 экз.
© ГОУ ВПО «Тюменский государственный архитектурно-строительный университет »
© Величко Т.И.
Редакционно-издательский отдел ГОУ ВПО «Тюменский государственный архитектурно-строительный университет »
СОДЕРЖАНИЕ
Основы молекулярно-кинетической теории____________________4 стр
Термодинамика ___________9 стр
Реальные газы____________14 стр
Жидкости __________ 14 стр
Твердые тела_____________ 15 стр
Список рекомендуемой литературы __________________________16 стр
ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ (МКТ)
ОСНОВНЫЕ ПОНЯТИЯ
1. Плотность 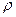 вещества,
вещества,
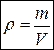 ,
, 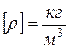 . (1)
. (1)
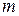 - масса вещества в объеме
- масса вещества в объеме 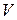 .
.
2. Концентрация 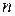 молекул,
молекул,
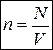 ,
, 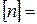 м-3 . (2)
м-3 . (2)
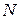 -число молекул в объеме
-число молекул в объеме 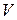 .
.
3. Давление
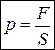 ,
, 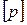 =Па (Паскаль). (3)
=Па (Паскаль). (3)
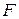 - сила, действующая на площадку
- сила, действующая на площадку 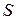 , перпендикулярную направлению силы.
, перпендикулярную направлению силы.
1мм.рт.ст.=133 Па.
4. Количество молекул (атомов) вещества, содержащее столько же молекул, сколько их содержит 12 грамм изотопа углерода 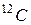 , называется молем вещества. Один моль вещества содержит
, называется молем вещества. Один моль вещества содержит 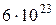 молекул. Это число называется числом Авогадро
молекул. Это число называется числом Авогадро 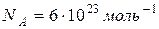 . Масса моля вещества называется молярной массой
. Масса моля вещества называется молярной массой 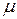 . Молярная масса определяется по таблице Менделеева, например для воды (
. Молярная масса определяется по таблице Менделеева, например для воды ( 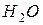 ),
),
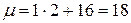 г/моль=
г/моль= 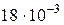 кг/моль
кг/моль
Количество молей (количество вещества)
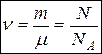 ,
, 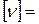 моль. (4)
моль. (4)
5. Масса одной молекулы 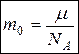 . Плотность
. Плотность 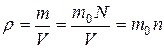 .
.
6. Температура 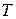 по шкале Кельвина связана с температурой
по шкале Кельвина связана с температурой 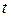 по Цельсию:
по Цельсию:
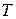 =
= 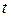 +273 K.
+273 K.
ИДЕАЛЬНЫЙ ГАЗ
Идеальным называется газ, удовлетворяющий трем условиям:
1. можно пренебречь взаимодействием молекул;
2. можно пренебречь собственным объемом молекул;
3. соударения молекул можно рассматривать как абсолютно упругие.
Азот N2, кислород O2 , водород H2, пары воды H2O и другие газы при условиях, близких к нормальным, удовлетворяют условиям идеальности.
Нормальные условия (н.у.):
температура t=0°С и давление p=760 мм.рт.ст.=101,3 кПа.
Характеристиками молекул газа при их хаотичном тепловом движении являются:
1. Эффективный диаметр d молекулы – минимальное расстояние, на которое сближаются молекулы при соударениях.
2. Средняя арифметическая скорость молекул

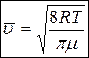 . (5)
. (5)
3. Средняя длина свободного пробега 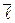 молекулы - среднее расстояние, которое пролетает молекула между двумя последовательными соударениями,
молекулы - среднее расстояние, которое пролетает молекула между двумя последовательными соударениями,
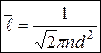 . (6)
. (6)
4. Среднее число 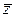 столкновениймолекул в единицу времени,
столкновениймолекул в единицу времени,
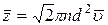 . (7)
. (7)
Законы идеального газа:
1. Закон Дальтона: давление 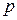 смеси газов равно сумме парциальных давлений
смеси газов равно сумме парциальных давлений
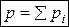 . (8)
. (8)
Парциальное давление – это давление, которое оказывал бы один газ из смеси, если бы занимал весь объем сосуда. Из закона Дальтона следует, что количество молей ν смеси равно сумме молей отдельных газов
ν=ν1+ν2+ν3+… (9)
2. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
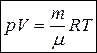 , (10)
, (10)
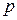 -давление газа,
-давление газа, 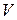 - его объем,
- его объем, 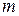 – масса газа,
– масса газа, 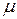 - молярная масса,
- молярная масса, 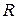 =8,31 Дж/(моль·К) – газовая постоянная,
=8,31 Дж/(моль·К) – газовая постоянная, 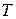 – температура в Кельвинах.
– температура в Кельвинах.
Также уравнение состояния записывают в форме
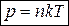 , (11)
, (11)
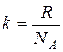 =1,38·10-23 Дж/K – постоянная Больцмана,
=1,38·10-23 Дж/K – постоянная Больцмана, 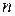 - концентрация молекул.
- концентрация молекул.
Основное уравнение МКТ
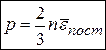 , (12)
, (12)
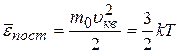 - средняя кинетическая энергия поступательного движения молекул,
- средняя кинетическая энергия поступательного движения молекул,
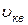 - средняя квадратичная скорость молекул,
- средняя квадратичная скорость молекул, 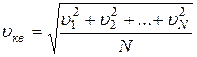 .
.
