Периодическая система элементов
Ранее мы показали, что данному фиксированному n соответствует n2 состояний, отличающихся 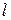 и
и 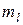 . Спиновое квантовое число
. Спиновое квантовое число 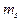 принимает два значения. Следовательно, в состоянии с данным n могут находится не более 2n2 электронов,
принимает два значения. Следовательно, в состоянии с данным n могут находится не более 2n2 электронов, 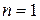 - 2 электрона;
- 2 электрона; 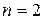 - 8 электронов и т.д.
- 8 электронов и т.д.
Совокупность электронов, имеющих одинаковые значения n, образуют оболочку. Оболочки подразделяются на подоболочки, отличающиеся значением орбитального квантового числа 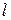 .
.
В соответствии со значением n оболочкам дают обозначения, заимствованные из спектроскопии:
| n | … | ||||||
| Обозначение | K | L | M | N | O | P | … |
Обозначение 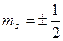 обычно заменяют
обычно заменяют 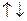 . В таблице приведено распределение электронов в трех первых оболочках: K, L, M, число электронов в подоболочках, а также электронная конфигурация заполненных подоболочек (показывающая, сколько электронов находится в данном состоянии, например -
. В таблице приведено распределение электронов в трех первых оболочках: K, L, M, число электронов в подоболочках, а также электронная конфигурация заполненных подоболочек (показывающая, сколько электронов находится в данном состоянии, например - 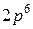 - шесть электронов в состоянии
- шесть электронов в состоянии 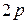 ). Как показано в таблице, подоболочки могут обозначаться двумя способами.
). Как показано в таблице, подоболочки могут обозначаться двумя способами.
Начнем рассмотрение периодической системы с атома водорода, имеющего один электрон. Каждый последующий атом будем получать, увеличивая заряд ядра на единицу и добавляя один электрон, помещая его в состояние согласно принципу Паули.
В атоме водорода имеется всего один электрон в состоянии - 1s с произвольной ориентацией спина. Т.е.: 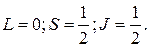 . Соответственно, основной терм имеет вид:
. Соответственно, основной терм имеет вид: 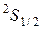 .
.
| Оболочка | 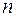 | 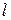 | 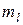 | 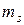 | Подоболочка | Число электронов | Электронная конфигурация |
| K | 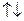 | 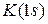 | 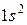 | ||||
| L | 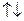 | 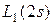 | 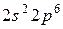  | ||||
 | 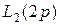 | ||||||
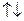 | |||||||
| -1 | 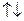 | ||||||
| M | 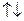 | 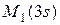 | 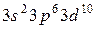 | ||||
 | 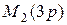 | ||||||
 | |||||||
| -1 | 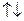 | ||||||
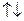 | 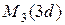 | ||||||
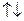 | |||||||
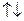 | |||||||
| -1 | 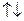 | ||||||
| -2 | 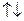 |
Гелий. Оба электрона могут находиться в К-оболочке, но должны иметь антипараллельную ориентацию спина, рис.52. Тогда можно записать электронную конфигурацию атома: 1s2 (два электрона в состояни1s).Основным термом будет (L=0, S=0, J=0): 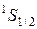 .
.
Литий. Третий электрон может заполнять лишь уровень 3s, поскольку оболочка К занята полностью. Электронная конфигурация лития запишется: 1s2 2s. Основное состояние определяется из L=0;S=1/2;J=1/2 и записано на рис.53. Третий электрон слабее связан с ядром и определяет оптические и химические свойства атома.
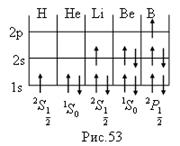 Бериллий. Электронная конфигурация - 1s 2 2s 2 и основной терм на рис.53.
Бериллий. Электронная конфигурация - 1s 2 2s 2 и основной терм на рис.53.
У последующих шести элементов (бор, углерод и т.д.) происходит заполнение электронами подоболочки 2p, неон имеет уже полностью заполненные оболочки K и L, образующие устойчивую систему, подобную системе гелия, что обуславливает специфические свойства инертных газов.
Заполнение подоболочек с точки зрения принципа Паули можно представить следующим образом:
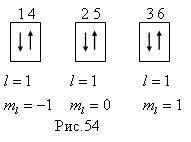 Например, 2р - подоболочка. Возможно наличие шести электронов. Тогда можно представить себе три "ячейки", отличающиеся хотя бы одним из квантовых чисел (кроме спинового), рис.54. В каждой такой ячейке может находиться два электрона с антипараллельными спинами. Сначала идет заполнение ячеек по одному электрону и лишь затем по второму. Следом за неоном идет натрий, который кроме полностью заполненных К и L оболочек имеет один электрон в подоболочке 3s. Его (Na) электронная конфигурация: 1s 22s2 2p6 3s . Основной терм натрия будет:
Например, 2р - подоболочка. Возможно наличие шести электронов. Тогда можно представить себе три "ячейки", отличающиеся хотя бы одним из квантовых чисел (кроме спинового), рис.54. В каждой такой ячейке может находиться два электрона с антипараллельными спинами. Сначала идет заполнение ячеек по одному электрону и лишь затем по второму. Следом за неоном идет натрий, который кроме полностью заполненных К и L оболочек имеет один электрон в подоболочке 3s. Его (Na) электронная конфигурация: 1s 22s2 2p6 3s . Основной терм натрия будет: 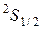 .
.
Электрон 3s - валентный, оптический. В связи с этим свойства натрия подобны свойствам лития.
Когда начинает заполняться p-оболочка определение терма основного состояния естественно затрудняется. При этом необходимо использовать эмпирические правила Хунда:
 Наименьшей энергией обладает состояние с наибольшим возможнымзначением S и с наибольшим возможном при таком значении S значением L. При этом квантовое число J равно L–S , если заполнено не более половины подоболочки, и равно L+S в остальных случаях.
Наименьшей энергией обладает состояние с наибольшим возможнымзначением S и с наибольшим возможном при таком значении S значением L. При этом квантовое число J равно L–S , если заполнено не более половины подоболочки, и равно L+S в остальных случаях.
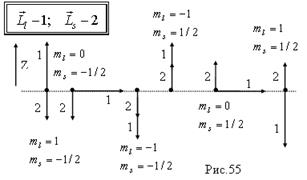
На рис.55 показаны шесть возможных состояний в р-подоболочке. Используя показанные конфигурации, можно определить термы основного состояния при заполнении p-подоболочки (от углерода до неона).
С Z=12 идет последовательное заполнение оболочки М. Аргон сходен по свойствам с Ne. Калий (Z=19). Электрон должен бы заполнять 3d-состояние в М оболочке. Однако в оптическом и химическом отношениях атом калия схож с литием и натрием, которые имеют валентный электрон в s - состоянии. Т.е., 19-й электрон тоже в s (4s)-состоянии. Т.е., заполнение N-оболочки начинается у калия при незаполненной М-оболочке. Это означает, что в результате взаимодействия электронов состояние с n=4, 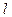 =0 имеет меньшую энергию, чем состояние с n=3,
=0 имеет меньшую энергию, чем состояние с n=3, 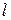 =2. Для кальция также электрон оказывается в s-состоянии.
=2. Для кальция также электрон оказывается в s-состоянии.
В последующих элементах происходит заполнение М-оболочки. Далее N-оболочка заполняется до криптона (Z=36), у которого опять (как у неона и аргона) s и р-состояния наружной оболочки заполнены полностью. Криптоном заканчивается четвертый период.
Подобные рассуждения применимы и к другим элементам. Отметим, что и начальные элементы последующих периодов: Rb; Cs; Fr являются щелочными металлами, а их последний электрон в s-состоянии.
Завершаются периоды инертными газами. Для лантаноидов (Лантан, Z=57) до лютеция (Z=71) заполнение подоболочки 4f, которая может содержать 14 электронов, начинается после того, как полностью заполняются подоболочки 5s;5p;6s. Поэтому внешняя р-оболочка (6s2) оказывается постоянной. Аналогично для актинидов (Z=89 до Z=103) одинакова Q-оболочка (7s2).
Таким образом, родственными атомами являются:
1. Инертные газы - одинаковые внешние оболочки из восьми электронов (заполненные s и р-состояния)
2. Щелочные металлы - один валентный электрон в s -состоянии.
3. Щелочно – земельные металлы - два s- электрона во внешней оболочке.
Причиной отступления от «правильного» порядка заполнения электронных оболочек является экранирование ядра атома внутренними электронами. Кроме того, мы рассмотрели только случай слабого спин-орбитального взаимодействия, 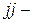 связь осталась за пределами данного курса.
связь осталась за пределами данного курса.
