Теплоемкость твёрдых тел. Испарение, сублимация, плавление, кристаллизация
В качестве модели твердого тела рассмотрим правильно построенную кристаллическую решетку, в узлах которой частицы (атомы, ионы, молекулы), принимаемые за материальные точки, колеблются около своих положений равновесия — узлов решетки — в трех взаимно перпендикулярных направлениях. Таким образом, каждой составляющей кристаллическую решетку частице приписывается три колебательных степени свободы, каждая из которых, согласно закону равнораспределения энергии по степеням свободы (см. § 50), обладает энергией kT.
Внутренняя энергия моля твердого тела
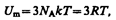
где NA — постоянная Авогадро; NAk=R (R — молярная газовая постоянная). Молярная теплоемкость твердого тела
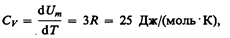 (73.1)
(73.1)
т. е. молярная (атомная) теплоемкость химически простых тел в кристаллическом
состоянии одинакова (равна 3R) и не зависит от температуры. Этот закон был эмпирически получен французскими учеными П. Дюлонгом (1785—1838) и Л. Пти (1791—1820) и носит названиезакона Дюлонга и Пти.
Если твердое тело является химическим соединением (например, NaCl), то число частиц в моле не равно постоянной Авогадро, а равно nNA, где n — число атомов в молекуле (для NaCl число частиц в моле равно 2NA, так, в одном моле NaCl содержится NA атомов Na и NA атомов Cl). Таким образом, молярная теплоемкость твердых химических соединений
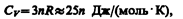
т. е. равна сумме атомных теплоемкостей элементов, составляющих это соединение.
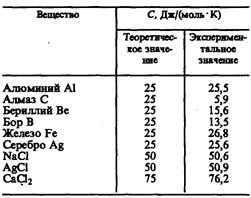
Как показывают опытные данные (табл. 4), для многих веществ закон Дюлонга и Пти выполняется с довольно хорошим приближением, хотя некоторые вещества (С, Be, В) имеют значительные отклонения от вычисленных теплоемкостей. Кроме того, так же как и в случае газов (см. § 53), опыты по измерению теплоемкости твердых тел при низких температурах показали, что она зависит от температуры (рис. 113). Вблизи нуля кельвин теплоемкость тел пропорциональна Т3, и только при достаточно высоких температурах, характерных для каждого вещества, выполняется условие (73.1). Алмаз, например, имеет теплоемкость, равную 3R при1800 К! Однако для большинства твердых тел комнатная температура является уже достаточно высокой.
Таблица 4
Расхождение опытных и теоретических значений теплоемкостей, вычисленных на основе классической теории, объяснили, исходя из квантовой теории теплоемкостей, А. Эйнштейн и П. Дебай.
Как в жидкостях, так и в твердых телах всегда имеется некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам и которые способны оторваться от поверхности жидкости или твердого тела и перейти в окружающее их пространство. Этот процесс для жидкости называетсяиспарением(илипарообразованием), для твердых тел —сублимацией (иливозгонкой).
Испарение жидкостей идет при любой температуре, но его интенсивность с повышением температуры возрастает. Наряду с процессом испарения происходит компенсирующий его процесс конденсации пара в жидкость. Если число молекул, покидающих жидкость за единицу времени через единицу поверхности, равно числу молекул, переходящих из пара в жидкость, то наступает динамическое равновесие между процессами испарения и конденсации. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным (см. также § 62).
Для большинства твердых тел процесс сублимации при обычных температурах незначителен и давление пара над поверхностью твердого тела мало; оно повышается с повышением температуры. Интенсивно сублимируют такие вещества, как нафталин, камфора, что обнаруживается по резкому, свойственному им запаху. Особенно интенсивно сублимация происходит в вакууме — этим пользуются для изготовления зеркал. Известный пример сублимации — превращение льда в пар — мокрое белье высыхает на морозе.
Если твердое тело нагревать, то его внутренняя энергия (складывается из энергии колебаний частиц в узлах решетки и энергии взаимодействия этих частиц) возрастает. При повышении температуры амплитуда колебаний частиц увеличивается до тех пор, пока кристаллическая решетка не разрушится, — твердое тело плавится. На рис. 114, а изображена примерная зависимость Т (Q), где Q — количество теплоты, получаемое телом при плавлении. По мере сообщения твердому телу теплоты его температура повышается, а при температуре плавления Tпл, начинается переход тела из твердого состояния в жидкое. Температура Tпл остается постоянной до тех пор, пока весь кристалл не расплавится, и только тогда температура жидкости вновь начнет повышаться.
Нагревание твердого тела до Tпл еще не переводит его в жидкое состояние, поскольку энергия частиц вещества должна быть достаточной для разрушения кристаллической решетки. В процессе плавления теплота, сообщаемая веществу, идет на совершение работы по разрушению кристаллической решетки, а поэтому Tпл = const до расплавления всего кристалла. Затем подводимая теплота пойдет опять-таки на увеличение энергии частиц жидкости и ее температура начнет повышаться. Количество теплоты, необходимое для расплавления 1 кг вещества, называется удельной теплотой плавления.

Если жидкость охлаждать, то процесс протекает в обратном направлении (рис. 114, б; Q' — количество теплоты, отдаваемое телом при кристаллизации): сначала температура жидкости понижается, затем при постоянной температуре, равной Tпл, начинаетсякристаллизация, после ее завершения температура кристалла начнет понижаться. Для кристаллизации вещества необходимо наличие так называемыхцентров кристаллизации — кристаллических зародышей, которыми могут быть не только кристаллики образующегося вещества, но и примеси, а также пыль, сажа и т. д. Отсутствие центров кристаллизации в чистой жидкости затрудняет образование микроскопических кристалликов, и вещество, оставаясь в жидком состоянии, охлаждается до температуры, меньшей температуры кристаллизации, при этом образуется переохлажденная жидкость (на рис. 114, б ей соответствует штриховая кривая). При сильном переохлаждении начинается спонтанное образование центров кристаллизации и вещество кристаллизуется довольно быстро.
Обычно переохлаждение расплава происходит от долей до десятков градусов, но для ряда веществ может достигать сотен градусов. Из-за большой вязкости сильно переохлажденные жидкости теряют текучесть, сохраняя, как в твердые тела, свою форму. Эти тела получили название аморфных твердых тел; к ним относятся смолы, мех, сургуч, стекло. Аморфные тела, являясь, таким образом, переохлажденными жидкостями, изотропны, т. е. их свойства во всех направлениях одинаковы; для них, как и для жидкостей, характерен ближний, порядок в расположении частиц; в них в отличие от жидкостей подвижность частиц довольно мала. Особенностью аморфных тел является отсутствие у них определенной точки плавления, т. е. невозможно указать определенную температуру, выше которой можно было бы констатировать жидкое состояние, а ниже — твердое. Из опыта известно, что в аморфных телах со временем может наблюдаться процесс кристаллизации, например в стекле появляются кристаллики; оно, теряя прозрачность, начинает мутнеть и превращаться в поликристаллическое тело.
В последнее время широкое распространение в народном хозяйстве получили полимеры — органические аморфные тела, молекулы которых состоят из большого числа одинаковых длинных молекулярных цепочек, соединенных химическими (валентными) связями. К полимерам относятся как естественные (крахмал, белок, каучук, клетчатка и др.), так и искусственные (пластмасса, резина, полистирол, лавсан, капрон и др.) органические вещества. Полимерам присущи прочность и эластичность; некоторые полимеры выдерживают растяжение, в 5—10 раз превышающее их первоначальную длину. Это объясняется тем, что длинные молекулярные цепочки могут при деформации либо сворачиваться в плотные клубки, либо вытягиваться в прямые линии. Эластичность полимеров проявляется только в определенном интервале температур, ниже которого они становятся твердыми и хрупкими, а выше — пластичными. Хотя синтетических полимерных материалов создано очень много (искусственные волокна, заменители кожи, строительные материалы, заменители металлов и др.), но теория полимеров до настоящего времени полностью не разработана. Ее развитие определяется запросами современной техники, требующей синтеза полимеров с заранее заданными свойствами.

