Ковалентная полярная связь возникает между атомами различных неметаллов (HCl, CO2, N2O) – электронное облако связи смещается к атому с большей электроотрицательностью
Чем сильнее перекрываются электронные облака, тем прочнее ковалентная связь.
Электроотрицательность – способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
Свойства ковалентной связи: 1) энергия; 2) длина; 3) насыщаемость; 4) направленность.
Длина связи – расстояние между ядрами атомов, образующих связь.
Энергия связи – количество энергии, необходимое для разрыва связи.
Насыщаемость – способность атомов образовывать определенное число ковалентных связей.
Направленность ковалентной связи – параметр, определяющий пространственную структуру молекул, их геометрию, форму.
Гибридизация – выравнивание орбиталей по форме и энергии. Существует несколько форм перекрывания электронных облаков с образованием ?-связей и ?-связей (?-связь намного прочнее ?-связи, ?-связь может быть только с ?-связью).
ЭНЕРГИЯ СВЯЗИ, энергия, которую следует придать ядру атома для того, чтобы расщепить его на составляющие элементы (нейтроны и протоны). Перед тем, как ядро подвергнется делению (кроме случаев радиоактивного распада), оно должно получить необходимое количество этой энергии.
Ядро – система связанных нуклонов, состоящая из Z протонов (масса протона в свободном состоянии mp) и N нейтронов (масса нейтрона в свободном состоянии mn). Для того, чтобы разделить ядро на составные нуклоны, нужно затратить определенную минимальную энергию W, называемую энергией связи. При этом покоящееся ядро с массой М переходит в совокупность свободных покоящихся протонов и нейтронов с суммарной массой Zmp + Nmn. Энергия покоящегося ядра Мс2. Энергия освобождённых покоящихся нуклонов (Zmp + Nmn)с2. В соответствии с законом сохранения энергии Мс2 + W = (Zmp + Nmn)с2. Или W = (Zmp + Nmn)с2 - Мс2. Поскольку W > 0, то М < (Zmp + Nmn), т.е. масса, начального ядра, в котором нуклоны связаны, меньше суммы масс свободных нуклонов, входящих в его состав.
W растёт с увеличением числа А нуклонов в ядре (А = Z + N). Удобно иметь дело с удельной энергией связи  = W/A, т.е. средней энергией связи, приходящейся на один нуклон. Для большинства ядер
= W/A, т.е. средней энергией связи, приходящейся на один нуклон. Для большинства ядер 
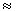 8 МэВ (1 МэВ = 1.6.10-13 Дж). Для разрыва химической связи нужна энергия в 106 раз меньше.
8 МэВ (1 МэВ = 1.6.10-13 Дж). Для разрыва химической связи нужна энергия в 106 раз меньше.
СРОДСТВО К ЭЛЕКТРОНУ
способность нек-рых нейтральных атомов, молекул и свободных радикалов присоединять добавочные эл-ны, превращаясь в отрицат. ионы. Мерой этой способности служит положит. энергия С. к э. c, равная разности энергии нейтрального атома (молекулы) в основном состоянии и энергии осн. состояния отрицат. иона, образовавшегося после присоединения эл-на.
У большинства атомов С. к э. связано с тем, что их внеш. электронные оболочки не заполнены (см. АТОМ). Таковы атомы Н и элементов 1-й группы периодической системы элементов (имеющие лишь 1 внеш. s-эл-н), а также атомы элементов 3—7-й групп (неполное число р-эл-нов). Атомы с двумя внеш. s-эл-нами, как правило, не обладают С. к э. (щелочноземельные элементы, Hg и др.). Захват добавочного эл-на атомами Fe, Co и Ni, у к-рых в норм. состоянии тоже 2 внеш. s-эл-на, приводит, как принято считать, к заполнению свободного места на внутр. оболочке 3d.
Величина c точно определена лишь для немногих атомов (данные о c молекул и радикалов б. ч. недостаточно надёжны). Прямо измерить c атомов можно, напр., определив длину волны света l0, соответствующую т. н. порогу фотоотщепления (фотоотрыва) эл-на от отрицат. иона: c=hс/l0 (с — скорость света в вакууме). Этим методом были установлены величины c атомов С, О, S, I, Сl. Типичные значения c атомов (в эВ): Н — 0,754; С — 1,2; О - 1,46; S — 2,07—2,33; F — 3,40—3,62; Сl — 3,82; I — 3,08—3,23. Величины ОС молекул и радикалов колеблются в широких пределах. В ряде случаев они составляют доли эВ, но для NO2 c>3 эВ, для ОН c»2 эВ, для CN c>3 эВ.
