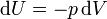Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких-либо изменений внутри самой машины. Такая гипотетическая машина получила названиевечного двигателя (perpetuum mobile) первого рода. Многочисленные попытки создать такую машину неизменно заканчивались провалом. Любая машина может совершать положительную работу A над внешними телами только за счет получения некоторого количества теплоты Q от окружающих тел или уменьшения ΔU своей внутренней энергии.
Применим первый закон термодинамики к изопроцессам в газах.
1. Визохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно,
|
2. Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0).
3. В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением
|
4. Первый закон термодинамики для изобарного процесса дает:
|
5. При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0.
6. В изотермическом процессе температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, ΔU = 0.
Первый закон термодинамики для изотермического процесса выражается соотношением
|
№9
Изотермический процесс (T = const,следовательноΔU = 0).
По первому закону термодинамики: Q = A'.
Газ совершает работу A' за счет подводимого тепла Q (A'>0, Q>0).
Совершение работы внешними силами A (сжатие газа) требует отвода тепла Q от газа для сохранения его температуры (A>0, Q<0).
Изохорный процесс (V = const,следовательно A = 0).
По первому закону термодинамики:ΔU = Q.
Нагревание газа в закрытом сосуде приводит к увеличению его внутренней энергии U (температуры) (Q>0, ΔU>0).
Охлаждение газа в закрытом сосуде приводит к уменьшению его внутренней энергии U (температуры) (Q<0, ΔU<0).
Изобарный процесс (p = const).
По первому закону термодинамики:Q = ΔU + A'.
Подводимое к газу тепло Q частично идет на увеличение внутренней энергии U, а частично на совершение работы газом A' (Q>0, ΔU>0, A'>0).
Работа внешних сил A при изобарном сжатии газа требует отвода тепла Q от газа, одновременно уменьшается его внутренняя энергия U (Q<0, ΔU<0, A>0).
Адиабатный процесс - процесс, протекающий без теплообмена с окружающей средой (Q = 0).
По первому закону термодинамики: ΔU = A.
Вся работа внешних сил А идет только на увеличение внутренней энергии газа (A>0, ΔU>0).
Работа газа А' совершается только за счет потери внутренней энергии газа (A'>0, ΔU<0).
Полезные формулы:
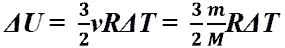 Изменение внутренней энергии
Изменение внутренней энергии
идеального одноатомного газа.
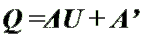 Количество теплоты, переданное телу,
Количество теплоты, переданное телу,
идет на изменение его внутренней энергии
и на совершение им работы (Первый закон термодинамики).
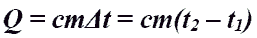 Количество теплоты при нагревании и охлаждении газа.
Количество теплоты при нагревании и охлаждении газа.
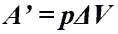 Работа газа при изобарном процессе (p = const)
Работа газа при изобарном процессе (p = const)
№10
Теплоемкость идеального газа — это отношение количества теплоты, сообщенного газу, к изменению температуры δТ, которое при этом произошло.
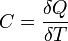
Адиабатический
В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть 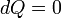 . Однако, объём, давление и температура меняются, то есть
. Однако, объём, давление и температура меняются, то есть 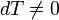 .
.
Следовательно, теплоемкость идеального газа в адиабатическом процессе равна нулю: 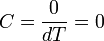 .
.
[править]Изотермический
В изотермическом процессе постоянна температура, то есть 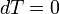 . При изменении объема газу передается (или отбирается) некоторое количество тепла. Следовательно, теплоемкость идеального газа стремится к бесконечности:
. При изменении объема газу передается (или отбирается) некоторое количество тепла. Следовательно, теплоемкость идеального газа стремится к бесконечности: 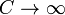
[править]Изохорный
В изохорическом процессе постоянен объем, то есть 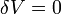 . Элементарная работа газа равна произведению изменения объема на давление, при котором происходит изменение (
. Элементарная работа газа равна произведению изменения объема на давление, при котором происходит изменение ( 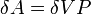 ). Первое Начало Термодинамики для изохорического процесса имеет вид:
). Первое Начало Термодинамики для изохорического процесса имеет вид:
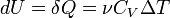
А для идеального газа
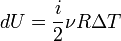
Таким образом,
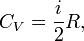
где 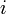 — число степеней свободы частиц газа.
— число степеней свободы частиц газа.
[править]Изобарный
В изобарном процессе ( 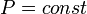 ):
):
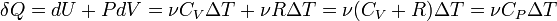
CP=δQ/νΔT=CV+R=((i+2)/2)*R
№12
Адиабати́ческий, или адиаба́тный проце́сс (от др.-греч. ἀδιάβατος — «непроходимый») — термодинамический процесс в макроскопической системе, при котором система не обменивается тепловой энергией с окружающим пространством .  Серьёзное исследование адиабатических процессов началось в XVIII веке[1].
Серьёзное исследование адиабатических процессов началось в XVIII веке[1].
Если термодинамический процесс в общем случае являет собой три процесса — теплообмен, совершение системой (или над системой) работы и изменение её внутренней энергии[5], то адиабатический процесс в силу отсутствия теплообмена ( 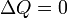 ) системы со средой сводится только к последним двум процессам[6]. Поэтому, первое начало термодинамики в этом случае приобретает вид[7][Комм 1]
) системы со средой сводится только к последним двум процессам[6]. Поэтому, первое начало термодинамики в этом случае приобретает вид[7][Комм 1]
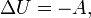
где 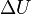 — изменение внутренней энергии тела,
— изменение внутренней энергии тела, 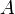 — работа, совершаемая системой.
— работа, совершаемая системой.
Изменения энтропии S системы в обратимом адиабатическом процессе вследствие передачи тепла через границы системы не происходит[8]:
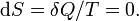
Здесь 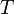 — температура системы,
— температура системы, 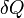 — теплота, полученная системой. Благодаря этому адиабатический процесс может быть составной частью обратимого цикла[8].
— теплота, полученная системой. Благодаря этому адиабатический процесс может быть составной частью обратимого цикла[8]. 
[править]Работа газа
Совершение над газом работы на элементарном участке dh. Совершаемая работа показана красными лампочками
Поясним понятие работы применительно к адиабатическому процессу. В частном случае, когда работа совершается через изменение объёма, можно определить её следующим способом: пусть газ заключён в цилиндрический сосуд, плотно закрытый легко скользящим поршнем, если газ будет расширяться, то он будет перемещать поршень и при перемещении на отрезок 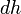 совершать работу[9][10]
совершать работу[9][10]
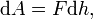
где F — сила, с которой газ действует на поршень. Перепишем уравнение:
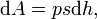
где s — площадь поршня. Тогда работа будет равна[9][10]
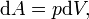
где 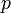 — давление газа,
— давление газа, 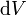 — малое приращение объёма. Аналогично видно, что уравнение выполняется и для сосудов с произвольной поперечной формой сечения. Данное уравнение справедливо и при расширении на произвольных объёмах. Для этого достаточно разбить поверхность расширения на элементарные участки
— малое приращение объёма. Аналогично видно, что уравнение выполняется и для сосудов с произвольной поперечной формой сечения. Данное уравнение справедливо и при расширении на произвольных объёмах. Для этого достаточно разбить поверхность расширения на элементарные участки 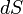 на которых расширение одинаково[9].
на которых расширение одинаково[9].
Основное уравнение термодинамики примет вид[11]:
|
Уравне́ние Пуассо́на — эллиптическое дифференциальное уравнение в частных производных, которое, среди прочего, описывает
- электростатическое поле,
- стационарное поле температуры,
- поле давления,
- поле потенциала скорости в гидродинамике.
Оно названо в честь знаменитого французского физика и математика Симеона Дени Пуассона.
Это уравнение имеет вид: 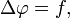
где 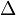 — оператор Лапласа или лапласиан, а
— оператор Лапласа или лапласиан, а 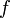 — вещественная или комплексная функция на некотором многообразии.
— вещественная или комплексная функция на некотором многообразии.
В трёхмерной декартовой системе координат уравнение принимает форму:
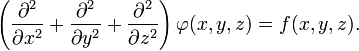
В декартовой системе координат оператор Лапласа записывается в форме 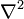 и уравнение Пуассона принимает вид:
и уравнение Пуассона принимает вид:
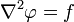
Если f стремится к нулю, то уравнение Пуассона превращается в уравнение Лапласа (уравнение Лапласа — частный случай уравнения Пуассона):
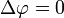
Уравнение Пуассона может быть решено с использованием функции Грина; см., например, статью экранированное уравнение Пуассона. Есть различные методы для получения численных решений. Например, используется итерационный алгоритм — «релаксационный метод»
№13
. Работа газа при адиабатном процессе равна убыли внутренней энергии:
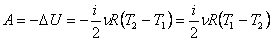 .
.
№14
Цикл Карно́ — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Состоит из 2 адиабатических и 2 изотермических процессов.
КПД тепловой машины Карно
Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно
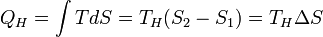 .
.
Аналогично, при изотермическом сжатии рабочее тело отдало холодильнику
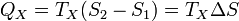 .
.
Отсюда коэффициент полезного действия тепловой машины Карно равен
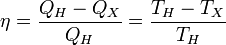 .
.
Из последнего выражения видно, что КПД тепловой машины Карно зависит только от температур нагревателя и холодильника. Кроме того, из него следует, что КПД может составлять 100 % только в том случае, если температура холодильника равнаабсолютному нулю. Это невозможно, но не из-за недостижимости абсолютного нуля (этот вопрос решается только третьим началом термодинамики, учитывать которое здесь нет необходимости), а из-за того, что такой цикл или нельзя замкнуть, или он вырождается в совокупность двух совпадающих адиабат и изотерм.
Поэтому максимальный КПД любой тепловой машины будет меньше или равен КПД тепловой машины Карно, работающей при тех же температурах нагревателя и холодильника. Например, КПД идеального цикла Стирлинга равен КПД цикла Карно.
№15
Второй закон термодинамики. Энтропия.