Класифікація фазових переходів
РОЗДІЛ 1. ФАЗОВІ ПЕРЕХОДИ
Фазові переходи 1-го та 2-го роду
В термодинаміці розрізняють гомогенніі гетерогеннісистеми.
- В гомогенних(однорідних) системах фізичні величини [густина, концентрація,питома ентропія, показник заломлення світла] при переході від одної точки простору до іншої змінюються неперервно.
- На відміну від них, гетерогеннісистеми складаються з кількох гомогенних(однорідних) частин, які відокремлені одна від одної чіткими межами. Згадані співіснуючі гомогенні частини гетерогенної системи і називають фазами.[1]
Можна дати і дещо інше означення: термодинамічна фаза – це термодинамічно рівноважний стан речовини, який відрізняється від інших можливих станів цієї ж речовини за своїми фізичними властивостями.
Величини, що мають різні значення у співіснуючих фазах, мають назву густинних змінних (густина, концентрація, питома ентропія, питома енергія, намагніченість феромагнетика, тощо).
Приклади різних фаз (при одному агрегатному стані ) :
- Рідина і надплинна рідина;
- Тверде тіло у пара- і феромагнітному стані;
- Різні кристалічні модифікації льоду;
- Феромагнітні системи з різними напрямками вектора намагніченості в
нульовому зовнішньому магнітному полі нижче точки Кюрі.[1,2]
Слід розрізняти фазові і агрегатні стани:
ƒ- агрегатний стан характеризується щільністю упаковки молекул (чи атомів), характером руху молекул.
ƒ- фазовий стан – характеризується дальністю сил взаємодії і фізичними термодинамічними властивостями.
Слід також відрізняти поняття фази та компоненти (в багатокомпонентній системі). Багатокомпонентною називають систему, що складається з різних хімічних речовин. При цьому компонентою називають хімічну речовину, концентрацію якої можна вважати незалежною термодинамічною змінною. [2]
Правило фаз Гіббса
В стані термодинамічної рівновага має місце нерівність:
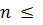 k – s + 2 (1.1)
k – s + 2 (1.1)
де n – число фаз, k – число речовин (компонентів), s – число рівнянь хімічних реакції, що можуть проходити в системі (іноді пишуть як: число термодинамічних ступенів вільності (k - s) + 2- n = f≥0).
Приклади до правила фаз Гіббса:
ƒ- хімічних реакцій немає, компонента (речовина) одна – n ≤ 3 – співіснувати в термодинамічній рівновазі можуть не більше трьох фаз – потрійна точка.
ƒ- єдина фаза (одна речовина, реакцій немає) – f = (1-0) +2 – 1= 2 – стан одної фази термодинамічний стан однозначно задається двома термодинамічними параметрами. (серед p,V,T одна змінна – залежна – термічне рівняння стану p = p(V, T)).[3]
ƒ- співіснування двох фаз (однієї речовини, хім. реакції немає): f = (1-0) +2 –2=1– незалежна змінна лише одна – виникає поняття кривої фазової рівноваги (уже не p = p(V, T), а p = p(T)).
Дослід показує, що при зміні термодинамічних умов кількість однієї за співіснуючих фаз збільшується, а кількість другої – зменшується. Тобто одна фаза системи переходить в іншу фазу. [2]
Класифікація фазових переходів
Класифікація фазових переходів:
- фазові переходи, що супроводжуються стрибком перших похідних від термодинамічних потенціалів, називаються фазовими переходами I роду або перервними фазовими переходами Приклади: перехід рідина-пара.
ƒ - якщо перші похідні термодинамічних потенціалів при фазовому переході неперервні, то його називаються неперервним фазовим переходом. Приклади: точка Кюрі феромагнетика.[4]
Класифікацію неперервних фазових переходів можна деталізувати далі:
- якщо перші похідні неперервні, а другі мають стрибок, то фазовий перехід називають фазовим переходом ІІ роду.(перехід ІІ роду – дуже екзотичне, якщо взагалі існуюче явище; як правило другі похідні мають розриви, але зі степеневими особливостями) ;
- якщо другі похідні при фазовому переході мають степеневі особливості (проходять через ∞), то говорять про критичний фазовий перехід (чи,коротше, критичне явище).[3]
