Второй закон термодинамики
Удельная теплоемкость и ее виды. Удельной теплоемкостью с называют количество теплоты q, которое требуется для изменения температуры единицы количества вещества на 1 градус: с = q/ΔT, с = = dq/dT.
В зависимости от способа измерения единицы количества вещества, характера термодинамического процесса и величины интервала температур различают несколько видов удельных теплоемкостей.
1. В зависимости от единицы количества вещества — 1 кг, 1 м3, 1 кмоль удельную теплоемкость различают:
- массовая удельную теплоемкость с [Дж/(кг • К)];
- объемная удельную теплоемкость с' [Дж/(м3 ■ К)];
- мольная удельную теплоемкость с 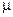 [Дж/(кмоль • К)].
[Дж/(кмоль • К)].
Связь между ними выражается следующей зависимостью
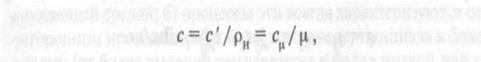
где рн — плотность при нормальных физических условиях.
Количество теплоты определяется соответственно
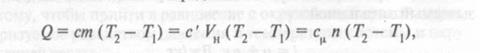
где т — масса газа; VH — объем газа, приведенный к нормальным физическим условиям; п — число молей газа.
2. Удельная теплоемкость зависит от характера термодинамического процесса, т.е. от способа подвода теплоты удельную теплоемкость различают:
- теплоемкость при постоянном давлении (изобарную) ср;
- теплоемкость при постоянном объеме (изохорную) cv.
Понятия «теплоемкость при постоянной температуре» и «адиабатная теплоемкость» редко применяются, так как при Т= const означает, что теплообмен с окружающей средой отсутствует.
Отношение к= ср/ cv называют показателем адиабаты.
3. Поскольку теплоемкость изменяется с температурой, в зависимости от интервала температур удельную теплоемкость различают:
- истинную с;
- среднюю ст .
Истинной называют удельную теплоемкость, соответствующую бесконечно малому интервалу температур:
с = dq / dT.
Средней называют удельную теплоемкость, соответствующую конечному интервалу изменения температуры:
ст = q/(T2 — Т1,).
При практических расчетах обычно пользуются табличными данными средних теплоемкостей в интервале температур от 0 до t °С.
В этом случае количество теплоты, необходимое для нагрева 1 кг рабочего тела от 0 до t1 °С или до t2 °С, составит
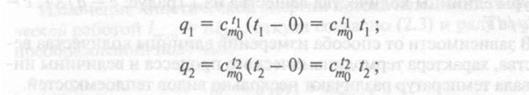
где 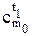 и
и 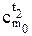 — табличные значения теплоемкостей в интервалах температур (0 — t1 °С) и (0 — t2 °С).
— табличные значения теплоемкостей в интервалах температур (0 — t1 °С) и (0 — t2 °С).
Количество теплоты, необходимое для нагрева 1 кг тела от t1, до t2, определяется как разность
q=q2 - q1 = 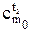 t2 -
t2 - 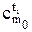 t1 , Дж/кг.
t1 , Дж/кг.
Энтальпия. В ряде случаев оказывается целесообразным объединение параметров и и рv в общий калорический параметр, называемый энтальпией:
i = и + pv, Дж/кг.
Энтальпия — термодинамическая функция, имеющая смысл полной (внутренней и внешней) энергии системы. Она складывается из внутренней энергии и и внешней упругой энергии рv, обусловленной наличием внешнего давления окружающей среды р, т.е. pv — работа, которую надо затратить, чтобы ввести рабочее тело объемом v в среду, имеющую давление р.
Энтальпия измеряется в тех же единицах, что и теплота, работа и внутренняя энергия, т.е.Дж/кг.
Энтропия.В термодинамике пользуются еще одним параметром состояния рабочего тела — энтропией, устанавливающей связь между количеством теплоты q и температурой Т (Р. Клаузиус, 1850).
Обозначают энтропию газа через S и выражают в Дж/К. Энтропию, отнесенную к 1 кг газа, называют удельной энтропией газа, и обозначают через s и выражают в Дж/(кг·К).
Тогда , количество теплоты, участвующее в том или ином термодинамическом процессе при изменении рабочеготела от состояния Т1 до Т2, можно выразить следующим образом:
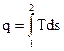 .
.
Для получения решения на практике пользуются функциональной зависимостью между T и s , которую называют Т,s-диаграммой, графическое изображение подвода теплоты выглядит следующим образом:
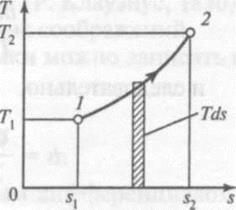
Рис. Графическое изображение подвода теплоты в Т,s-диаграммой
Энтропию нельзя измерить, ее смысл затрудительно продемонстрировать с помощью наглядных пособий, но можно понять по следующим интерпретациям.
1. Энтропия — мера ценности теплоты, ее работоспособности и технологической эффективности. Можно сказать, что для изолированной системы (нагреватель — рабочее тело) Δs = 0, при получении от нагревателя количества теплоты q1 энтропия s1 = q1 /Т1, откуда следует, что чем меньше s1 т.е. чем выше Т1, тем больше совершаемая системой работа.
Повседневный опыт свидетельствует, что чем температура теплоносителя выше при том же количестве теплоты q, т.е. чем меньше энтропия s= q/T, тем теплота ценнее, поскольку шире может быть использована не только для совершения работы как таковой, но и для технологических нужд — выплавки металла, отопления и т.д.
2. Энтропия — мера потери работы вследствие необратимости реальных процессов. Чем больше необратим процесс в изолированной системе, тем больше возрастает энтропия s2 >> s1 и тем большая доля энергии не превращается в работу, рассеивается в окружающую среду.
3. Энтропия — мера беспорядка. Если установить некоторую меру неупорядоченности макросистемы — неупорядоченности расположения и движения частиц D? то можно записать 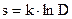 .
.
Следовательно, возрастание беспорядка означает возрастание энтропии, рассеивание энергии. При подводе теплоты увеличивается хаотичность теплового движения частиц и энтропия возрастает. Наоборот, охлаждение системы при постоянном объеме есть извлечение из нее теплоты, а следовательно, и энтропии; упорядоченность системы при этом повышается, а энтропия уменьшается.
При конденсации газа в жидкость молекулы занимают более определенные положения, упорядоченность их расположения скачкообразно увеличивается, что соответствует скачкообразному уменьшению энтропии. При дальнейшем понижении температуры тепловое движение становится все менее интенсивным, беспорядок — все меньшим, а значит, и все меньшей становится энтропия.
Когда жидкость превратится в твердое вещество, молекулы (ионы) образуют правильные кристаллические решетки, т.е. неупорядоченность опять уменьшится, а с нею уменьшится и энтропия и т.д. Такая закономерность позволяет предположить, что при нуле абсолютной температуры тепловое движение полностью прекратится и в системе установится максимальный порядок, т.е. неупорядоченность и энтропия станут равными нулю. Это предположение согласуется с опытом, но не поддается опытной проверке, идо абсолютный нуль температуры недостижим.
Второй закон термодинамики. Второй закон термодинамики, как и первый, является опытным законом, основывающимся на многовековых наблюдениях ученых. Однако установлен он был только в середине XIX в.
Наблюдения за явлениями природы показывают, что:
а) возникновение и развитие самопроизвольно протекающих в ней естественных процессов, работа которых может быть использована для нужд человека, возможно лишь при отсутствии равновесия между участвующей в процессе термодинамической системой и окружающей средой;
б) процессы эти всегда характеризуются односторонним протеканием от более высокого потенциала к более низкому (от более высокой температуры к более низкой или от более высокого давления к более низкому);
в) при протекании указанных выше процессов термодинамическая система стремится к тому, чтобы прийти в равновесие с окружающей средой, характеризуемое равенством давления и температуры системы и окружающей среды.
г) из наблюдений за явлениями природы следует также, что для того, чтобы заставить процесс протекать в направлении, обратном направлению протекания самопроизвольного процесса, необходимо затратить заимствуемую из внешней среды энергию.
Второй закон термодинамики представляет собой обобщение изложенных выше положений и заключается в том, что
1) самопроизвольное протекание естественных процессов возникает и развивается при отсутствии равновесия между участвующей в процессе термодинамической системой и окружающей средой;
2) самопроизвольно происходящие в природе естественные процессы, работа которых может быть использована человеком, всегда протекают лишь в одном направлении — от более высокого потенциала к более низкому;
3) ход самопроизвольно протекающих процессов происходит в направлении, приводящем к установлению равновесия термодинамической системы с окружающей средой, и по достижении этого равновесия процессы прекращаются;
4) процесс может протекать в направлении, обратном самопроизвольному процессу, если энергия для этого заимствуется из внешней среды.
Формулировки второго закона термодинамики, данные различными учеными, вылились в форму постулатов, полученных в результате развития положений, высказанных французским ученым Сади Карно.
В частности, постулат немецкого ученого Клаузиуса состоит в том, что тепло не может переходить от холодного тела к теплому без компенсации. Сущность постулата английского ученого Томсона заключается в том, что невозможно осуществить цикл теплового двигателя без переноса некоторого количества теплоты от источника теплоты с более высокой температурой к источнику с более низкой температурой.
Эту формулировку надо понимать так, что, для того чтобы работала периодически действующая машина, необходимо, чтобы были минимум два источника теплоты различной температуры; при этом в работу может быть превращена лишь часть теплоты, забираемой из высокотемпературного источника, в то время как другая ее часть должна быть передана низкотемпературному источнику.
4. РЕАЛЬНЫЕ ГАЗЫ, ВОДА И ВОДЯНОЙ ПАР
К реальным газам в технической термодинамике принято относить перегретые пары некоторых жидкостей. В отличие от воображаемого идеального газа реальный газ при соответствующих условиях может быть сжижен, т.е. сконденсирован, или же переведен в твердое состояние.
В технике широко применяют пары различных веществ: воды, аммиака, хлористого метила, сернистого ангидрида и др. Наибольшее применение имеет водяной пар, являющийся основным рабочим телом паровых двигателей, отопительных и других устройств. Известно, что законы идеальных газов нельзя распространить на рабочие тела, состояние которых не очень удалено от жидкой фазы.
Из ряда предлагавшихся уравнений состояния, применимых для реального газа с известной степенью приближенности, можно отметить уравнение Ван-дер-Ваальса:
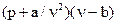 ,
,
где а и b — постоянные для данного газа.
Слагаемым а/v2 в первом множителе учитывается влияние сил взаимодействия молекул, во втором — вычитаемым b учитывается влияние объема молекул (поскольку в идеальном газе, для которого и справедливо уравнение состояния Клапейрона, объем молекул полагается равным нулю).
Практически пользоваться уравнением Ван-дер-Ваальса нельзя, так как оно дает результаты, недостаточно точные для нужд современной паротехники. Наиболее точным является в настоящее время уравнение состояния реальных газов, разработанное М.П. Вукаловичем и Н.И. Новиковым (МЭИ) применительно в основном к водяному пару. Однако для практических целей пользование этим, как и другими уравнениями состояния реального газа, неудобно вследствие сложности их и необходимости выполнения трудоемких вычислений. Обычно пользуются готовыми данными, которые берут из таблиц водяного пара или из i,s-диаграммы водяного пара.
На современных крупных тепловых электростанциях основным двигателем является паровая турбина, где в качестве рабочего тела используется водяной пар, который получают в паровых котлах. Поэтому изучение термодинамических свойств паров рассмотрим на примере водяного пара.
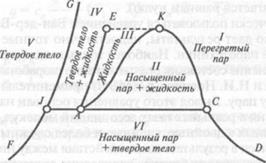
Водяной пар. На рис. 2.10 приведены фазовые состояния воды. Здесь может быть выделено несколько областей:
| |||
 | |||
|
Рис. 2.10. Фазовая диаграмма для водяного пара в Т,s-диаграмме:
I— газообразное состояние (перегретый пар, обладающий свойствами реального газа);
II— равновесное состояние воды и насыщенного водяного пара (двухфазное состояние); двухфазную область II называют также областью парообразования;
III, ограниченная изотермой ЕК, — жидкое состояние (вода);
IV— равновесное состояние твердой и жидкой фаз;
V— твердое состояние.
Области III, II и II, I отделены так называемыми пограничными линиями: левой АК и правой KD. Общая для левой и правой пограничных линий (и областей I, II и III) точка К обладает особыми свойствами и называется критической точкой. Она имеет определенные параметры ркр,  кр и Ткр ,при которых кипящая вода переходит в перегретый пар, минуя двухфазную область. Отсюда следует, что вода (точнее, ее жидкая фаза) не может существовать при температурах выше Ткр . Будучи нагретой до этой температуры, весь объем воды практически мгновенно должен превратиться в пар. Вместе с тем пар при давлениях больших, чем ркр, и при охлаждении до температуры Ткр непосредственно превращается в жидкость, минуя область влажного пара.
кр и Ткр ,при которых кипящая вода переходит в перегретый пар, минуя двухфазную область. Отсюда следует, что вода (точнее, ее жидкая фаза) не может существовать при температурах выше Ткр . Будучи нагретой до этой температуры, весь объем воды практически мгновенно должен превратиться в пар. Вместе с тем пар при давлениях больших, чем ркр, и при охлаждении до температуры Ткр непосредственно превращается в жидкость, минуя область влажного пара.
Критическая точка воды имеет следующие параметры:
р= 22,136 МПа; Ткр = 374,15 °С;  кр = 0,00326 м3/кг.
кр = 0,00326 м3/кг.
Значения р,Т, v и s для обеих пограничных линий (кипения и сухого насыщенного пара) приводятся в специальных таблицах термодинамических свойств водяного пара.
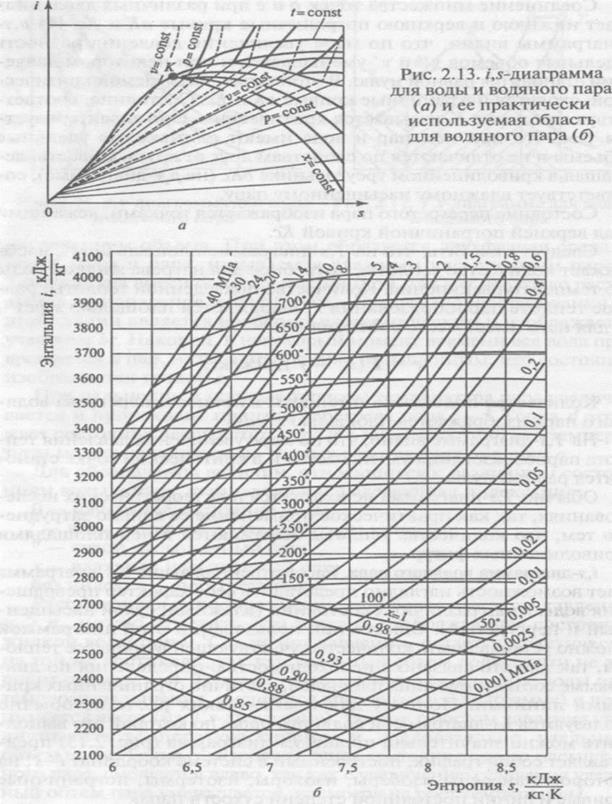
i,s-диаграмма водяного пара. Рассмотренная выше Т,s-диаграмма дает возможность наглядно представить себе характер превращения воды в пар различных состояний (влажный, сухой насыщенный и перегретый). Однако при пользовании этой диаграммой сложно устанавливать количество участвующей в процессе теплоты, так как это связано с необходимостью определения по диаграмме соответствующих площадей, частично ограниченных кривыми линиями. Поэтому для практических расчетов обычно пользуются i,s-диаграммой водяного пара, по которой это выполнить можно значительно проще.
i,s-диаграмма (рис. 2.13) представляет собой график, построенный в системе координат i—s, на котором нанесены изобары (р-const), изохоры (v-const), изотермы (t-const), пограничные кривые и линии постоянной степени сухости пара (паросодержания (х-cоnst).
Контрольные вопросы
1.Укажите основные параметры состояния рабочего тела и единицы измерения их.
2.Дайте определение средней и истинной теплоемкости, чем отличается теплоемкость ср от су?
3.Объясните сущность первого закона термодинамики и напишите его математическое выражение.
4.Какова сущность второго закона термодинамики? Дайте некоторые формулировки этого закона.
5.Покажите в p,v- и Т,s-диаграммах характерные области и линии для воды и водяного пара.
6.Покажите в Т,s -диаграмме площадки, изображающие количество теплоты на подогрев воды, теплоту парообразования, теплоту на перегрев пара.
