Параметры состояния систем
P-абсолютное давление;Т-абсолютная температура;ν–удельный объем;U-внутр. энергия;h-энтальпия;s –энтропия
Равновесным состоянием называется состояние тела, при котором во всех его точках объема Р, υ и Т и все другие физические свойства одинаковы.F(P,ν, T)=0
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией.
1. отсутствуют силы взаимод. м/у молекулами; 2. молкулы представляют собой материальные точки
Взаимосвязь параметров ид газа: PV=mRT;
U=f(T); h= U(сумма внутр. энергии)+ P*ν;
ds= dQ(кол-во подводимого/отводимого тепла)/T
3. Внутренняя энергия – это сумма кинетической энергии движения частиц + потенциальная энергия их взаимодействия(отсутств. в ид. газах. U=f(T,ν)- для всех; U=f(T)- для ид.газов [Дж]
Энтальпия – параметр состояния системы, численно равный сумме внутренней энергии и произведения P на V: h = U + PV(параметр удобен при анализе открытых систем)[Дж/кг]
Энтропия – параметр сост. системы, полный дифференциал кот. dS числ.равен отношению бесконечно малого кол-ва теплоты dQ к абсолютной температуре Т, при кот. эта телпота подводится или отводится ds= dQ/T [Дж/К]
4. Термодинамический процесс – если изменяется хотя бы 1 параметр состояния системы, то говорят, что совершается термический процесс.
Пар-ры сост. в исх. и конечных точках не зависят от характера процесса.
Обратимый – процесс, при проведении которого как в прямом, так и в обратном направлениях и система, и окр. среда возвращаются в исходное состояние.
Изопроцессы: изохорный(ν=const), изобарный (p=const), изотермический (Т=соnst), адиабатный (dq=0)
Круговой процесс – процесс при кот. система периодически возвращ. в исх. сост.
Изменение всех пар-ов сост=0
5. Газовые смеси – механическая смесь газов, не вступающая в хим.реакции. Свойства: 1.температура всех компонентов одинаковая и равна температуре смеси; 2. каждый компонент занимает весь предоставленный объем.
Состав газовойсмеси может быть задан массовыми долями и молярными массами: gi=mi/m – массовая доля; ri=vi/v(объемн. доли) где r1, r2, rn – объемные доли;
V1, V2,., Vn – парциальные объемы газов смеси;
V– объем смеси газов.
средняя молярная масса смеси газов определяется суммой произведений объемных долей на молярные массы отдельных газов, из которых состоит смесь.
μ=m(масса смеси)/M(число молей); m=∑mi; mi=μMi; μ=∑μiMi/M=∑μνi(молярная доля); M=Mi;
Mi=mi/μi=1/(∑mi/m*1/ μi)= 1/(∑qi\Mi)
газовая постоянная R=Rμ/M; ∑gi=1; ∑ri=2
R=Rμ/μ=8314/μ [Дж/кг*К]
Понятие температуры
Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Температура одинакова для всех частей изолированной системы, находящейся в термодинамическом равновесии. Если изолированная термодинамическая система не находится в равновесии, то с течением времени переход энергии (теплопередача) от более нагретых частей системы к менее нагретым приводит к выравниванию температуры во всей системе (нулевое начало термодинамики). В равновесных условиях температура пропорциональна средней кинетической энергии частиц тела.
Температура не может быть измерена непосредственно. Об изменении температуры судят по изменению других физических свойств тел (объёма, давления, электрического сопротивления, эдс, интенсивности излучения и др.), однозначно с ней связанных (так называемых термодинамических свойств). Любой метод измерения температуры связан с определением температурной шкалы.
Методы измерения температуры различны для различных диапазонов измеряемых температур, они зависят от условий измерений и требуемой точности. Их можно разделить на две основные группы: контактные и безконтактные. Для контактных методов характерно то, что прибор, измеряющий температуру среды, должен находиться в тепловом равновесии с ней, т.е. иметь с ней одинаковую температуру. Основными узлами всех приборов для измерения температуры являются чувствительный элемент, где реализуется термометрическое свойство, и измерительный прибор, связанный с элементом.
Согласно молекулярно-кинетической теории идеального газа температура есть величина, характеризующая среднюю кинетическую энергию поступательного движения молекул идеального газа. Учитывая термодинамический смысл температуры, можно свести измерение температуры любого тела к измерению средней кинетической энергии молекул идеального газа.
Однако на практике измеряют не энергию молекул по их скорости, а давление газа, которое находится в прямопропорциональной зависимости от энергии.
По молекулярно-кинетической теории идеального газа температура Т является мерой средней кинетической энергии поступательного движения молекул:
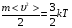 , (1)
, (1)
где 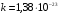 Дж/К – постоянная Больцмана;
Дж/К – постоянная Больцмана;
Т – абсолютная температура в кельвинах.
Основное уравнение молекулярно-кинетической теории идеального газа, устанавливающее зависимость давления 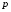 от кинетической энергии поступательного движения молекул газа, имеет вид:
от кинетической энергии поступательного движения молекул газа, имеет вид:
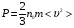 , (2)
, (2)
где 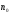 - число молекул в единице объёма, т.е. концентрация.
- число молекул в единице объёма, т.е. концентрация.
Используя уравнение (1) и (2), получаем зависимость
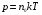 (3)
(3)
между давлением и температурой, которая позволяет установить, что давление идеального газа пропорционально его абсолютной температуре и концентрации молекул, где
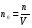 (4)
(4)
Измерение температуры основано на следующих двух опытных фактах:
а) если имеются два тела, каждое из которых находится в тепловом равновесии с одним и тем же третьем телом, то все три тела имеют одну и ту же температуру;
б) изменение температуры всегда сопровождается непрерывным изменением по меньшей мере одного из параметров, не считая самой температуры, характеризующего состояния тела, например: объём, давление, электропроводность и др. Первое из этих положений позволяет сравнивать температуры различных тел, не приводя их в соприкосновение между собой.
Второе положение позволяет выбрать один из параметров в качестве термометрического.
В общем случае температура определяется как производная от энергии в целом по его энтропии. Так определяемая температура всегда положительная (поскольку кинетическая энергия всегда положительная), её называют температурой или температурой по термодинамической шкале температур и обозначают Т. За единицу абсолютной температуры в системе СИ (Международная система единиц) принят кельвин (К). См. «Введение». Часто температуру измеряют по шкале Цельсия ( 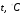 ), она связана с Т (К) равенством
), она связана с Т (К) равенством
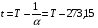 ;
; 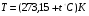 (5)
(5)
где  - термический коэффициент объёмного расширения газа.
- термический коэффициент объёмного расширения газа.
