Первое начало термодинамики
Первое начало термодинамики представляет собой одну из форм записи закона сохранения энергии. Оно было сформулировано независимо друг от друга Ю. Р. Майером (1842), Д. П. Джоулем (1843) и Г. Л. Гельмгольцем (1847). Двое из них (Майер и Гельмгольц) были врачами и, закладывая основы термодинамики, рассматривали преобразования энергии как в неживой природе, так и в биологических системах. Термодинамика с первых своих шагов была тесно связана с биологией и медициной. Закон сохранения энергии причисляется к трем великим открытиям XIX века.
Смысл первого начала термодинамики сводится к тому, что изменение внутренней энергии системы может произойти только при обмене энергией с окружающей средой. Энергетический обмен между системой и средой осуществляется двумя способами — посредством передачи тепла и путем совершения работы:
ΔU = Q - Аили Q = ΔU + А.(2)
Эта формула и выражает первое начало термодинамики.
Нужно обратить внимание на знаки в формуле (2). Принято считать положительным то тепло, которое система получает из окружающей среды. Работу же считают положительной, когда система производит ее над окружающими телами. Например, когда газ, расширяясь, толкает поршень, работу считаем положительной; если же газ сжимается поршнем, то работу считаем отрицательной.
Остановимся на способах совершения работы. Как известно, механическая работа вычисляется по формуле dA = f dl. Однако это лишь частный случай. Формы совершения работы могут быть весьма разнообразными:
dA=pdV—работа расширения газа;
dA = Udq—работа переноса заряда при разности потенциалов U;
dA=pосмdm/ρ -работа переноса вещества за счет осмотического давления;
dA = μxdv—работа, совершаемая при химической реакции.
В этих формулах f —сила (механическая), l — путь, пройденный системой, р—• давление, V — объем, q — электрический заряд, Роcм — осмотическое давление, m — масса, ρ — плотность, μxх— химический потенциал , v — число молей вещества, вступающих в реакцию.
Можно привести и другие аналогичные формулы. Все они имеют сходную структуру, так как отображают одно и то же — перемещение (перенос) какого-либо объекта под действием определенной причины (силы). Поэтому в общем виде можно написать
dA=Xdx или A =∫ Xdx, (4)
где х — так называемая обобщенная координата — величина, характеризующая перемещение (l) или перенос (V, q, m, v), a X — обобщенная сила — величина, характеризующая причину переноса (f, ρ, U, росм, μxх).
Из приведенных примеров видно, что обобщенными силами всегда являются интенсивные величины, а обобщенные координаты относятся к экстенсивным величинам.
Если одновременно на систему действует несколько обобщенных сил (то есть процессы переноса ее компонентов происходят под влиянием нескольких причин), то формула (4) примет вид
dA = ΣXidxil или A = Σ ∫Xi dxi. (5)
Используя принятые обозначения, формулу (2) можно записать в виде
Q= ΔU + Σ ∫Xidxi (6)
то есть количество тепла, полученное системой, определяется изменением внутренней энергии системы, а также суммой всех видов работы, совершенных системой. Эту формулу можно считать наиболее общим выражением первого начала термодинамики.
Если обобщенные силы постоянны, то формула (6) упрощается:
Q = ΔU + ΣXidxi или ΔU =Q- Σ Xidxi (7)
Применение обобщенных координат и сил характерно для термодинамического подхода к характеристике того или иного явления, что позволяет рассматривать самые различные процессы с единой точки зрения. Изменение любой обобщенной координаты можно сопоставить с переносом электрического заряда, то есть с током. А ток легко генерировать, измерять, направлять в цепи, состоящие из элементов с разнообразными свойствами. Поэтому электрическими цепями удается моделировать процессы диффузии, осмоса, химические реакции, теплоперенос и т. д, причем не только по отдельности, аив сложных взаимных связях. Такое моделирование уже применяется в медицине — моделируются перенос крови в аппаратах для искусственного кровообращения, диффузия газов в приборах для автоматической декомпрессии водолазов после пребывания на глубине и т. д. Использование электрического тока для моделирования особенно перспективно в связи с внедрением в медицину электронных вычислительных машин.
Для усвоения смысла и содержания первого начала термодинамики рассмотрим его приложение к анализу процессов в идеальном газе. В этом случае из всех форм работы учитывается только одна — работа расширения газа:
Q= ΔU + ∫pdv. (8)
При изохорическом процессе v=const, ΔU =0. Поэтому A=0 и ΔU=0. При изобарическом процессе p=const. Следовательно,
Q= ΔU+p ΔV (9)
При изотермическом процессе Т = const. Из (8) получаем:
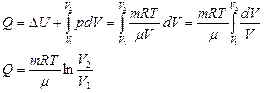
(учитывая, что ΔU = 0). (10)
Рассмотрим еще адиабатический процесс, при котором система не обменивается теплом с окружающей средой (Q=0), — процесс, протекающий в системе с идеальной теплоизоляцией. На первый взгляд, такие процессы редко встречаются в природе, но это не так. Передача тепла — относительно медленный процесс. Те процессы, которые протекают гораздо быстрее, чем теплообмен, можно считать адиабатическими. К адиабатическим процессам относится любой взрыв Термодинамические процессы в организме спортсмена, бегущего стометровку, тоже можно считать адиабатическими, пренебрегая теплообменом, происходящим в течение десятка секунд.
Для адиабатического процесса
ΔU =-A или 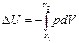
Из этой формулы следует, что при адиабатическом расширении газа (dV>0) его внутренняя энергия уменьшается, то есть газ охлаждается. Поэтому при сбросе давления в барокамере там становится холодно. При адиабатическом сжатии газ нагревается.
