Строение электронных оболочек сложных атомов
При дальнейшем развитии теории Бора оказалось, что всё было просто, пока мы имеем один протон и один электрон. Попытки объяснить с её помощью спектры испускания и поглощения для атомов с большим числом электронов показали, что здесь должны учитываться и другие условия, которые значительно увеличивают число дозволенных энергетических уровней атома. В своей работе, посвящённой решению этого вопроса Зоммерфельд пришел к выводу, что наряду с круговыми (боровскими) орбитами имеют место и эллиптические, а состояние каждого электрона в атоме характеризуется 4 квантовыми числами:
1. n - главное квантовое число. Оно определяет стационарные энергетические уровни атома (оболочки), которые наряду с цифрами могут обозначаться прописными буквами латинского алфавита.
| n | |||||||
| K | L | M | N | O | P | Q |
2. l - орбитальное квантовое число - определяет энергетические подуровни атома, соответствующие дозволенным значениям орбитального момента импульса электрона Ll:
|
Ll=(l+1)ħ=nħ; Ll=mVrn.
В ядерной модели l обуславливает форму (эллиптичность) орбиты электрона
|
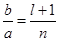
где l= 0, 1, 2, 3, 4, 5, …, (n-1). Наряду с цифрами квантовые числа могут обозначаться и малыми буквами латинского алфавита (s, p, d, f, g, h, …). 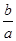 - соотношение большой и малой полуосей эллиптических орбит.
- соотношение большой и малой полуосей эллиптических орбит.
3. ml - магнитное квантовое число. Оно характеризует разрешённые положения, при которых проекция момента импульса Ll' на заданное направление Z кратна ħ
|
См. рис. 7.
Если n=3, то l= n-1=0, 1, 2; a ml=0, ±1, ±2.
3. ms - спиновое квантовое число. Характеризует ориентировку (знак) магнитного момента (спина) электрона
|
ms=±½
Электроны с одинаковыми главными квантовыми числами образуют электронные оболочки атома. В соответствии с остальными квантовыми числами в каждой оболочке количество электронов не может быть больше некоторого числа.
При заполнении оболочек должен выполняться принцип запрета Паули, он утверждает, что в атоме не может быть более чем одного электрона в данном энергетическом состоянии (все квантовые числа которого совпадают), это состояние описывается четырьмя квантовыми числами: n, l, ml, и ms.
Если n=1, то ml и l=0, следовательно, первая оболочка атома не может содержать более двух электронов с различными значениями спина ms=±½; так для оболочки с номером n=2 остальные квантовые числа могут принимать значения: l=0, 1; ml=-1, 0, 1 и ms=±½, то есть вторая оболочка может содержать 8 электронов (см. рис. 7).
В невозбуждённом состоянии все подоболочки атома, кроме самой верхней (валентной), заполнены и квантовые переходы между ними запрещены в соответствии с принципом Паули. При возбуждении атома электроны с внешних подоболочек переходят на более высокие уровни в состояние с большей энергией (поглощение света). Если же атом возбуждён, то в некоторых верхних подоболочках существуют незаполненные состояния, в которые могут переходить электроны из возбуждённого состояния с большими значениями энергии. Такой переход сопровождается излучением кванта света. Наиболее просты спектры излучения щелочных металлов, у которых на внешней подоболочке имеется всего один электрон. Спектр атома гелия, у которого в невозбуждённом состоянии полностью заполнена единственная оболочка (n=1) более сложен, в оптическом диапазоне можно наблюдать до девяти спектральных линий. Ещё более сложное строение спектра излучения имеет такой многоэлектронный атом, как атом ртути (Hg). Атомные спектры занимают диапазон длин волн от УФ до ближней ИК.
Молекулярные спектры
Дискретность энергетического спектра свойственна не только атомам, она присуща любой системе взаимодействующих друг с другом микрочастиц - молекуле, полутвёрдому телу. Молекулы имеют более сложные спектры излучения, чем атомы. При соединении атомов в молекулу или кристалл претерпевают изменения их внешние (валентные) электронные оболочки, переходы между которыми ответственны за формирование спектра оптического диапазона испускания или поглощения. Это сопровождается расщеплением отдельных энергетических уровней в частично заполненные или свободные зоны. При этом число возможных электронных переходов и, следовательно, соответствующих им спектральных линий, возрастает. Оптические спектры молекул представляют собой уже не отдельные линии (переход с уровня на уровень), а совокупность близкорасположенных линий, характеризующих переход электронов с уровня в зону (серия близкорасположенных уровней энергии) или межзонные электронные переходы - таким образом формируется полосатый спектр излучения (поглощения). Молекулярные спектры гораздо сложнее атомарных, что определяется большой сложностью внутренних движений в молекуле, так как кроме энергии движения электронов относительно двух или более ядер (Eэл) в молекуле происходит колебательное движение атомов около положения равновесия (Eкол) и вращательное движение молекулы как целого (Eвр). Электронному, колебательному и вращательному движениям молекулы соответствуют три типа уровней энергии Eэл, Eкол, Eвр.
Согласно квантовой механике энергия этих трёх видов движений в молекуле может принимать только определённые значения - квантуется. Полная энергия молекулы E приближённо может быть представлена в виде суммы квантовых значений энергии:
E ≈ Eэл + Eкол + Eвр
(порядка от десятых долей до единиц электрон-вольт, эВ), где Eэл>>Eкол>>Eвр, где Eэл - порядка от десятых долей до единиц эВ;
Eкол ~ 10-2 ¸ 10-1 эВ; Eвр ~ 10-4 ¸ 10-2 эВ.
Следует отметить, что каждый вид энергии молекулы ответственен за формирование индивидуального для каждой молекулы спектра испускании (поглощения):
Eэл - полосы расположены в ближней ИК, видимой и УФ области спектра;
Eкол - полосы расположены, в основном, в средней и дальней ИК области спектра;
Eвр - полосы расположены в дальней ИК области и области СВЧ радиодиапазона, непосредственно примыкающей к ИК области оптического диапазона.
Таким образом, молекулярные спектры, в отличие от атомарных занимают более широкий диапазон длин волн от УФ до СВЧ области радиодиапазона. В зависимости от необходимости получить ту или иную информацию о молекулярном строении вещества, выбирают тот или иной диапазон длин волн, в котором будут производиться исследования спектров испускания или поглощения. Например, такую важную характеристику, как прочность межатомных связей в молекуле, можно получить, производя исследования спектров испускания или поглощения в ближней и средней ИК областях спектра (1 ¸ 40 мкм); тройные связи в органических молекулах соответствуют жёстким пружинам поглощения при λ ≈ 4,3 ¸ 5 мкм, что соответствует энергии кванта 0,3 ¸ 0,25 эВ, они прочнее двойных λ ≈ 5,3 ¸ 6,6 мкм (0,22 ¸ 0,19 эВ), которые в свою очередь прочнее одинарных C-O, C-N, C-C), поглощают при λ ≈ 7,7 ¸ 12,5 мкм (0,16 ¸ 0,19 эВ).
Чем прочнее связь, тем больше частота её колебаний, тем большая энергия требуется, чтобы возбудить молекулу. Если известна длина волны излучения (в мкм), то энергия кванта в эВ может быть рассчитана по формуле:
|
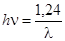 [эВ]
[эВ]