Скорость превращения и скорость реакции
Кинетика определяет динамику процесса, скорость его протекания. В химической технологии используют два показателя скорости химического процесса – скорость превращения вещества и скорость реакции.
Как быстро превращаются реагенты по этапам, определяется скоростью превращения вещества wi, где i - наименование вещества,
wi < 0, если вещество расходуется (исходное),
wi > 0, если вещество образуется (продукт).
Скорость превращения вещества wi показывает количество вещества, превращающегося в единицу времени в единице реакционного пространства.
Уравнение простой реакции представим в алгебраическом виде:
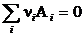 |
Соотношения между количествами DNi превращенных веществ:
DNi /ni = const, откуда следует аналогичное соотношение между скоростями превращения веществ: wi /ni = const.
Это отношение назовем скоростью реакции:
r = wi/ni (4)
Знак скорости превращения wi определяет, образуется или расходуется вещество. Скорость реакции r всегда положительна. Через скорость реакции вычисляются скорости превращения веществ
w i = ni r (5)
Если реакция сложная и вещество участвует в нескольких частных реакциях, то
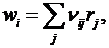 (6)
(6)
где rj - скорость j-ой реакции (этапа сложной реакции);
ni j - стехиометрический коэффициент i-го вещества в j-ой реакции.
Кинетическое уравнение.
Кинетическое уравнение, или кинетическая модель, реакции - зависимость скорости реакции от условий ее протекания.
Для элементарной реакции А + B = R + ... , т.е. протекающей в одну стадию, кинетическое уравнение строится на основе закона действующих масс:
r = kCACB,(7)
где k – константа скорости реакции; CA, CB – концентрации компонентов А и В.
Закон действующих масс применим строго только к элементарной реакции, в которой взаимодействие компонентов происходит в одну стадию.
В общем виде кинетическое уравнение будем представлять в виде
r = kf(C), (8)
где f(C) – функция зависимости скорости реакции от концентраций веществ – участников реакции.
При протекании сложной реакции кинетических уравнений вида (8) будет столько, сколько частных реакций с схеме превращения.
В кинетическом уравнении (8) k - константа скорости, зависящая от температуры по уравнению Аррениуса
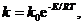 (9)
(9)
где Е - энергия активации.
Чем больше Е, тем сильнее увеличивается k с температурой.
Кинетическое уравнение вида (8) описывает скорость простой необратимой реакции (или частной реакции в сложной схеме превращения).
Простая обратимая реакция A = R есть фактически сложная реакция, в которой протекают две частные реакции: A превращается в R (прямая реакция) и R превращается в A (обратная реакция). Скорость превращения и, следовательно, скорость реакции r будет равна разности скоростей прямой r1 и обратной r2 реакций: r = r1 - r2 .
Пусть обе реакции первого порядка: r1 = k1CA, r2= k2CR. Тогда
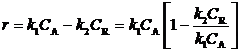 |
В преобразованном уравнении перед квадратной скобкой стоит выражение скорости прямой реакции.
В равновесии концентрации компонентов А и R будут, естественно, равновесными, равными CA.равн и CR,равн, и r = 0. Это возможно, если выражение в квадратных скобках равно нулю, т.е. CR.равн/CA.равн = k1/k2.
Термодинамическое условие равновесия устанавливает связь КP = (CR/CA)равн. Из последних двух уравнений следует связь кинетических (k1, k2) и термодинамического (КP) параметров:
k1/k2 = КP (10)
Зависимости k1, k2, КP от температуры имеют вид
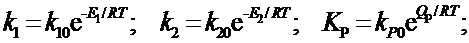 |
Подставив k1 и k2 в (10), получим
QP = E2 - E1 , (11)
т.е. тепловой эффект обратимой реакции равен разности энергий активации обратной и прямой реакций. Это соотношение следует из рассмотрения диаграммы "путь реакции - потенциал реагирующей системы" (рис. 2).
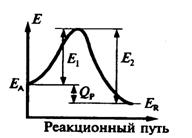
На диаграмме ЕA и ЕR потенциалы исходного вещества А и продукта R. Разность их QP высвобожденная энергия в результате превращения. Для превращения А в R необходимо преодолеть энергетический барьер величиной Е1 (энергия активации прямой реакции). В обратном направлении - величина такого барьера Е2. Разность между ними и дает величину теплового эффекта QP.
Для экзотермической реакции QP > 0 и Е2 > Е1 (как показано на рис. 2). Для эндотермической QP < 0 и Е2< Е1.
Скорость любой обратимой реакции всегда можно представить так:
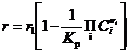 |
(12)
где r1 - скорость реакции в прямом направлении; - выражение закона действующих масс как в уравнении равновесия (12), но концентрации текущие, а не равновесные.
Химические процессы
Химический процесс – явление взаимодействия химической реакции и процессов переноса на молекулярном уровне, которые являются его составляющими.
Группа А (по ф/х признакам, характеризующих протекающую реакцию)
Группа Б ( физические признаки, характеризующие фазовый состав с реагентом)
Группа А:
- тип химической реакции:
- прямое химическое взаимодействие
- реакция с химическим воздействием (каталитическая реакция)
- реакция с физическим воздействием (под действием света, радиационная реакция, электрохимическая реакция)
- термодинамические показатели:
а) тепловой эффект:
· экзотермический процесс
· эндотермический процесс
· смешанный ХП
б) направленность превращения:
· обратимые ХП (до Хр)
· необратимые (нет равновесия, не достигается)
· смешанные ХП
- кинетические характеристики:
а) схема превращения
· простая реакция
· сложная (параллельная, последовательная)
· общий случай
б) кинетическая модель
r = f (С, T)
Группа Б
1.фазовый состав:
а) число участвующих фаз с реагентами:
· гомогенный ХП (все реагенты в одной фазе)
· Гетерогенный (многофазный)
- состояние фаз
а) газ
б) жидкость
в) твердое
основная цель изучения ХП изучение скорости превращения в нем и влияния на ХП условий протекания.
Гомогенный ХП – процесс протекающий в одной фазе. В этой фазе выровнены все условия протекания реакции во всем выделявшемся объеме.
- простоя реакция
а) необратимая
Гетерогенный химически процесс – процесс, в котором исходные вещества и в общем случае продолжают находится в разных фазах.
Аг + Втв = Rг + S
Гетерогенные процессы подразделяют:
- «газ - твердое»
а) адсорбция
б) десорбция
в) обжиг руды
г) окисление Ме
д) горение тв. топлива
- «газ - жид»
а) адсорбция
б) десорбция
в) дистилляция
г) ректификация (протекает с химическим взаимодействием)
- «жид - тв»
а) адсорбция
б) десорбция
в) кристаллизация
г) растворение
д) выщелачивание
- «жид - жид» (несмачивающие)
а) экстракция
б) эмульгирование
- «тв - тв»
а) процесс спекания (производство цемента)
б) высокотемпературный синтез неорг материала
- многофазная система.
В гетерогенных ХП реактанты находятся в разных фазах, а реакция протекает либо на границе раздела фаз, либо в одной из фаз.
1. «Газ – тв» («жид - тв»)
Aг + Bт = Rг (модель «сжимающаяся сфера»)
происходит уменьшение размера твердого материала по мере протекания процесса вплоть до его исчезновения
структура процесса:
В газовой фазе:
- I Перенос реагента А из газового потока к поверхности твердой частицы
- II Реакция А с твердым В на наружной поверхности частицы
- Перенос продукта реакции R от поверхности в газовый поток
В твердой фазе:
- II Реакция В с газообразным компонентом А поверхности
- Изменение (уменьшение) размера частицы r
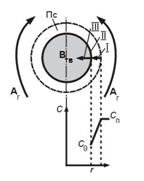
Допущения:
- тв частица – шарообразной формы.
- поверхность частицы тв. – равнодоступна, т.е. перенос между потоком и частицей, одинаков по всей поверхности.
- Тпотока = Тчастицы
По мере протекания процесса происходит уменьшение размера тв материала, вплоть до его исчезновения. ( размер = 0, реакция прошла до конца).
Математическая модель:
WI = WII
WI = -bSr(C0 - CП)
WII = -k(CП)Sr , где: b - коэффициент массообмена, k - константа скорости реакции, Sr – поверхность твердой частицы, tк - время полного превращения, C0 - концентрация А в потоке, R0 - первонач. радиус частицы, CП - концентрация А на поверхности, r - радиус частицы.
Наблюдаемая скорость:
Wн=-kCп=-kC0/(1+k/b)=Kн*C0
Наблюдаемая скорость превращения, отнесенная к одной частице:
Wн(част)= WнSr= Wн*4pr2= - 4pR02КНC0r2= -4pR02КНC0(1 - t/tк)2
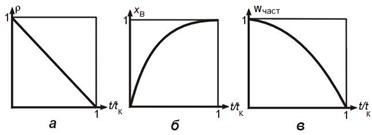
Изменение во времени t безразмерного радиуса частицы r (а), степени превращения твердого реагента xВ (б) и скорости превращения частицы Wн(част) (в) для гетерогенного процесса "сжимающаяся сфера". tк - время полного превращения.
r = 1 - t/tк;
хB = 1 - (1 - t/tк)1/3 ;
Wн(част) = -4pR02КНC0(1 - t/tк)2
Лимитирующие стадии и режимы процесса
· Если k<<b, т.е. реакция малоинтенсивна; CП~ C0, Wн=-kС0 кинетический режим: Химическая реакция – лимитирующая стадия
· Если k>>b, интенсивность массообмена мала; CП<< C0, Wн=-b С0 диффузионный режим: массоперенос – лимитирующая стадия
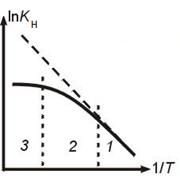 Влияние условий процесса на скорость превращения
Влияние условий процесса на скорость превращения
Влияние температуры
Зависимость наблюдаемой константы КН скорости превращения в гетерогенном процессе "сжимающаяся сфера" от температуры Т. Пунктир – k(T).
Режимы процесса:
1 – кинетический (k<<b, Kн=k);
2 - переходный;
3 – диффузионный (k>>b, Kн=b
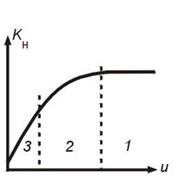
Влияние скорости газового потока
Зависимость скорости обтекания частицы u от температуры Т.
Режимы процесса:
1 – кинетический (при больших скоростях потока с возрастанием b режим не зависит от u);
2 - переходный;
3 – диффузионный
(b << k, Kн=b и увеличивается с увеличением скорости газового потока).
Интенсификация процесса
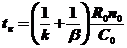
Пути уменьшения tк и, следовательно, интенсификации процесса:
· увеличение концентрации компонента в газе C0;
· дробление частиц - уменьшение R0;
· увеличение температуры и, следовательно, константы скорости k;
· увеличение скорости потока и, следовательно, коэффициента массообмена b.
· Влияние T и u ограничено соответствующим режимом процесса – кинетическим и диффузионным.
2. «газ – жид»
Взаимодействие "газ-жидкость" представлено в промышленности несколькими разновидностями по способу контакта фаз:
• барботаж (диспергированный газ в виде пузырей поднимается в слое жидкости);
• орошение (диспергированная в виде капель жидкость пролетает через газ);
• пленочное течение (жидкость пленкой стекает по поверхности, поток газа проходит вдоль нее);
• контакт в насадочной колонне (близко к пленочному течению - жидкость стекает по насадке в виде нерегулярной, возмущенной пленки, газ проходит в свободном пространстве);
• газо-жидкостной поток (потоки газа и жидкости движутся спутно, в одном направлении).
Применение гетерогенные процессы в системе «газ-жидкость»
широко используются в химической технологии
а) в качестве самостоятельных процессов получения необходимых продуктов
• Абсорбция аммиака растворами азотной кислоты при производстве аммиачной селитры или растворами серной кислоты при производстве сульфата аммония (производство удобрений)
• Хлорирование жидких ароматических углеводородов (органический синтез)
б) в качестве вспомогательных процессов очистки газовых смесей
• Абсорбция углекислого газа водными растворами моноэтаноламинами
• Абсорбция карбоната калия с целью очистки синтез-газа в производстве аммиака
• Абсорбция диоксида серы растворами сульфита и гидросульфита аммония при санитарной очистке газов
