Распределения элементов между взаимодействующими фазами при окислительном рафинировании.
В качестве примера рассмотрим основные закономерности распределения примесей между металлом и шлаком.
В реальных сталеплавильных процессах реакции окисления протекают в условиях, которые отличаются от стандартных. При этом для реакции
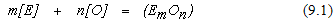
расчет изменения энергии Гиббса нужно проводить по уравнению
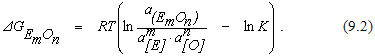
Предположим, что рассматриваемый элемент в ванне
сталеплавильного агрегата отсутствует, то есть 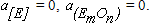
При вводе в ванну некоторого количества нового элемента 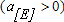 , если в шлаке его оксид по-прежнему отсутствует
, если в шлаке его оксид по-прежнему отсутствует 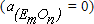 , а активность растворенного в металле кислорода равна некоторой конечной величине,
, а активность растворенного в металле кислорода равна некоторой конечной величине,
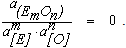
Из уравнения (9.2) видно, что при этом 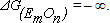 . Это означает, что при вводе в металл нового элемента часть его будет неизбежно окислена и в виде оксида перейдет в шлак.
. Это означает, что при вводе в металл нового элемента часть его будет неизбежно окислена и в виде оксида перейдет в шлак.
Если ввести в ванну некоторое количество нового элемента путем подачи его оксида в шлак 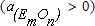 , тогда при отсутствии элемента в металле
, тогда при отсутствии элемента в металле 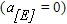 и активности растворенного в металле кислорода равной некоторой конечной величине
и активности растворенного в металле кислорода равной некоторой конечной величине
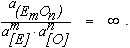
Из уравнения (9.2) следует, что при этом 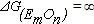 . Это означает, что при вводе в ванну нового элемента присадкой оксида в шлак часть его обязательно будет восстановлена и растворится в металле.
. Это означает, что при вводе в ванну нового элемента присадкой оксида в шлак часть его обязательно будет восстановлена и растворится в металле.
Аналогичным образом можно показать, что частичное окисление введенного в металл элемента или восстановление его оксида будет происходить и в случае, если в ванне сталеплавильного агрегата рассматриваемый элемент уже имеется, а реакция его окисления к моменту ввода дополнительного количества элемента в металл или его оксида в шлак достигла состояния термодинамического равновесия.
Таким образом, основная закономерность распределения элементов между шлаком и металлом при окислительном рафинировании заключается в следующем. В сталеплавильной ванне все элементы, оксиды которых растворяются в шлаке, частично окисляются, а их оксиды частично восстанавливаются. Поэтому элемент не может быть полностью сконцентрирован только в одной из взаимодействующих фаз. Некоторое его количество обязательно присутствует и в металле и в шлаке, распределяясь между ними в определенных соотношениях.
Равновесная концентрация элемента в металле и шлаке может меняться в широких пределах в зависимости от его химического сродства к кислороду. Например, при 1600оС и [O] = 0,01% при наличии в металле 0,5% Mn равновесное содержание оксида марганца в шлаке составит 15%, а при наличии в металле 0,5% Ni равновесное содержание оксида никеля в шлаке будет равным 2,5•10-4%. Наличием такого количества оксида никеля в шлаке с достаточной для практических целей точностью можно пренебречь и считать, что в сталеплавильных процессах никель вообще не окисляется. Тем не менее, следует помнить, что некоторое количество оксидов каждого из компонентов металлического расплава в шлаке обязательно присутствует.
Термодинамическим анализом, аналогичным приведенному выше, можно также показать неизбежность перехода элементов из одной фазы в другую при взаимодействии металла и футеровки, металла и атмосферы сталеплавильного агрегата, шлака и футеровки и т.д.
Обобщив все частные случаи, главную закономерность распределения элементов между взаимодействующими фазами при окислительном рафинировании можно
сформулировать следующим образом. По ходу плавки ни один из элементов не может быть полностью сконцентрирован только в одной из взаимодействующих фаз, некоторые его количества обязательно присутствуют в каждой из них.
Отсюда следует, что выплавленная сталь всегда представляет собой расплав сложного состава, который в определенных количествах содержит все без исключения компоненты металлической шихты, шлакообразующих материалов, футеровки и газовой фазы сталеплавильного агрегата.
Остаточное содержание примесей в металле. Остаточное содержание примесей, оксиды которых образуют самостоятельную конденсированную фазу.
Окисление элементов, оксиды которых образуют самостоятельную конденсированную фазу, в общем случае можно описать уравнением реакции
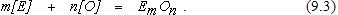
Приняв в качестве стандартного состояния при определении активности оксида чистое вещество и заменив активности элемента и кислорода в металле их концентрациями, выражение для константы равновесия реакции (9.3) получим в виде

Из уравнения (9.4) получим
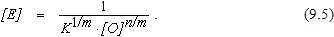
Анализ уравнения (9.5) показывает, что остаточное содержание элементов, оксиды которых выделяются в виде самостоятельной конденсированной фазы, определяется температурой и концентрацией растворенного в металле кислорода.
Необходимо обратить внимание на то, что в этих условиях остаточное содержание элемента не зависит от начальной его концентрации. От начальной концентрации элемента зависит только количество образующейся оксидной фазы. При высоком исходном содержании элемента оксидная фаза выделяется в большом количестве и наоборот.
Остаточное содержание примесей, оксиды которых растворяются в шлаке.Реакция окисления элемента, оксид которого растворяется в шлаке, в общем случае может быть записана в виде

Из уравнения (9.6) получим
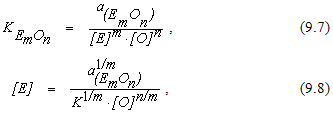
где
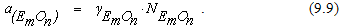
Из формулы (9.8) видно, что в этом случае остаточное содержание элемента определяется температурой, концентрацией кислорода в металле, а также активностью оксида элемента в шлаке. Поэтому при неизменной температуре определенному содержанию кислорода в металле могут соответствовать различные остаточные концентрации примеси. Это дает дополнительные возможности для управления химическим составом металлического расплава.
Например, если оксид элемента попадает в шлак только в результате окисления примесей металла, остаточное содержание элемента в металлическом расплаве определяется в первую очередь количеством (кратностью) шлака. Чтобы достичь минимального остаточного содержания примесей, плавку целесообразно вести при большой массе шлака.
Приводя металл в контакт со шлаком, который не содержит оксида удаляемого элемента 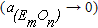 , можно достичь частичного окисления и перехода его в шлак при любых концентрациях примеси и кислорода в металле. На практике этот прием может быть реализован путем обновления шлака.
, можно достичь частичного окисления и перехода его в шлак при любых концентрациях примеси и кислорода в металле. На практике этот прием может быть реализован путем обновления шлака.
Для сохранения элемента в металле плавку целесообразно вести при
минимальном количестве шлака. С этой целью могут также применяться присадки его оксида в шлак.
Уменьшить остаточное содержание элемента в металле можно также путем ввода в шлак компонентов, которые взаимодействуют с его оксидом с образованием устойчивых химических соединений, в результате чего уменьшается коэффициента активности растворенного в шлаке оксида.
Остаточное содержание примесей, оксиды которых являются газообразными соединениями.
Реакцию окисления элемента, оксид которого является газообразным соединением, можно записать в виде
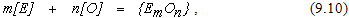
откуда
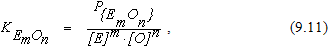
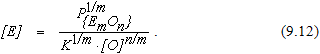
Из уравнения (9.12) можно видеть, что в этом случае остаточное содержание элемента помимо температуры и концентрации кислорода в металле оп-ределяется также величиной парциального давления оксида удаляемой примеси в контактирующей с металлом газовой фазе. Понизить парциальное давление оксида в газовой фазе можно путем окислительного рафинирования в вакууме, разбавляя продукты взаимодействия газом (продувка металла смесью кислорода и аргона в AOD-конвертерах), продувкой металла инертным газом, в котором парциальное давление оксида удаляемого элемента близко к нулю (химический вакуум).
