Восстановление оксидов железа водородом.
Реакции восстановления оксидов железа водородом можно описать следующими уравнениями:
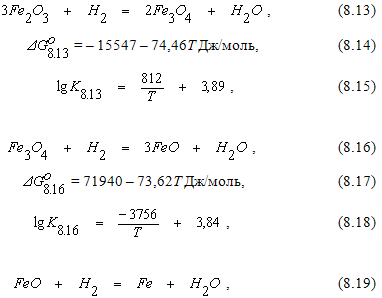
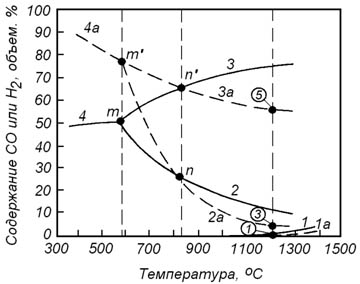
Рисунок 8.1 – Зависимость состава равновесной газовой фазы от температуры в реакциях восстановления оксидов железа оксидом углерода (сплошные линии) и водородом (пунктирные линии): 1 – для реакции (10.1); 2 – (10.4); 3 – (10.7); 4 – (10.10); 1а – (10.13); 2а – (10.16); 3а – (10.19); 4а – (10.22)
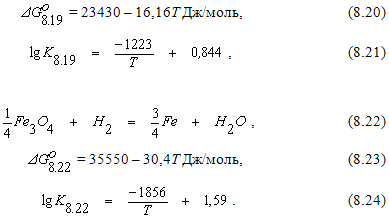
Анализ приведенных выше данных дает основания для следующих выводов:
· среди реакций восстановления оксидов железа водородом только реакция (8.13) является экзотермической. С ростом температуры отношение (%Н2О)/(%Н2) в равновесной газовой фазе этой реакции будет уменьшаться;
· реакции (8.16), (8.19) и (8.22) являются эндотермическими. Поэтому с ростом температуры отношение (%Н2О)/(%Н2) в равновесной газовой фазе этих реакций будет увеличивается.
Влияние температуры на изменение состава равновесной газовой фазы для каждой из реакций восстановления оксидов железа водородом показано на рисунке 8.1 пунктирными линиями.
Следует обратить внимание на то, что кривые, характеризующие составы равновесных газовых смесей для реакций восстановления оксидов железа оксидом углерода и водородом, пересекаются при температуре 810оС. Из анализа реакции водяного газа известно, что при соблюдении условия
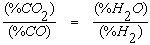
оксид углерода и водород при этой температуре обладают одинаковым химическим сродством к кислороду.
При температурах выше 810оС водород обладает большим химическим сродством к кислороду. Поэтому при восстановлении оксидов железа водородом объемное содержание восстановителя в газовой фазе может быть меньше, чем при восстановлении оксидом углерода.
При температурах ниже 810оС более высоким химическим сродством к кислороду обладает оксид углерода.
Прямое восстановление оксидов железа.
Реакции прямого восстановления оксидов железа
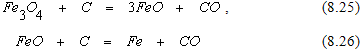
можно рассматривать как результат последовательного протекания реакций косвенного восстановления и последующего взаимодействия образовавшегося при этом превращении углекислого газа с углеродом.
Если реакции восстановления оксидов железа протекают с участием чистых веществ, температуры начала этих реакций можно определить из графика на рисунке 8.2.
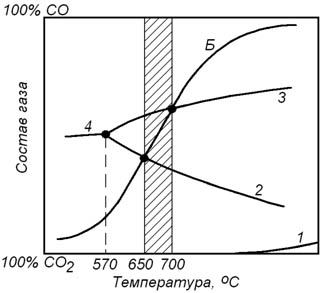
Рисунок 8.2 – Температуры начала реакций прямого восстановления оксидов железа при давлении 100 кПа
Из рисунка видно, что при давлении 100 кПа температура начала восстановления оксидов железа по реакциям (8.25) и (8.26) составляют соответственно 650 и 700оС.
При температурах менее 650оС обе реакции не обратимо протекают в направлении окисления железа и FeO до Fe3O4. При температурах 650 – 700оС железо окисляется, а Fe3O4 восстанавливается до FeO. При температурах выше 700оС Fe3O4 и FeO восстанавливаются до металлического железа.
ОБЩАЯ ТЕРМОДИНАМИЧЕСКАЯ ХАРАКТЕРИСТИКА ПРОЦЕССОВ ОКИСЛИТЕЛЬНОГО РАФИНИРОВАНИЯ.
