Идеальный газ. Понятие вакуума. Основное уравнение МКТ.
Идеальный газ-это газ взаимодействие между молекулами которого, пренебрежительно мало. Любой газ может быть идеальным, если он разряжен. Идеальность газа заключается в том что , что можно проследить за движением каждой частицы. Вакуум-это состояние газа при котором взаимодействие между частицами не происходит. Абсолютного вакуума не сущ-ет. Основное уравнение МКТ устанавливает связь давление газа с величинами характеризующими молекулами. Давление – это физическая величина равная отношению силы, действующей на площадь поверхности к этой площади. P=F/S Давление идеального газа зависит от числа молекул, от температуры, от объёма ссуда и от самого газа P=⅓*n*m0*υ2 – основное уравнение МКТ n=N/V - концентрация частиц N- число частиц V- объём m0 – масса 1 частицы υ – скорость частицы
12.Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона). Газовые законы.
Уравнение состояния идеального газа - это уравнение связывающее между собой 3 макроскопических параметра , характеризующих состояние идеального газа.Основное уравнение МКТ устанавливает связь давление газа с величинами характеризующими молекулами. R=Na*k=8.31 (Дж/моль*к) - универсальная газовая постоянная. PV=m/M*RT – уравнение состояния идеального газа P1V1/T1=P2V2/T2=P3V3/T3 – Уравнение Клапейра Изопроцессы- это процессы, протекающие при неизменном значении одногоиз параметров Газовые законы.
| Пост. параметра | Название процесса | Связь между параметрами | Формулировка закона | График |
| Т=const | Изотермический закон Бойля- Марриота | PV= const P1V1=P2V2 | Для газа данной массы, произведения давления на объём есть величина постоянная | 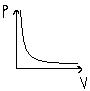 |
| P=const | Изобарный Гей-Люссака | V/T= const V1/T1=V2/T2 | Для газа данной массы отношение объёма к температуре есть величена постоянна | 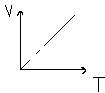 |
| V=const | Изохорный закон Шарля | P1/T1=P2/T2 P/T= const | Для газа данной массы отношение давления к температуре есть величена постоянна | 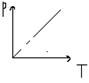 |
Испарение, конденсация, кипение. Насыщенный пар. Зависимость температуры от давления.
Испарение — процесс перехода вещества из жидкого состояния в газообразное (пар) с поверхности жидкости. Конденсация— переход вещества в жидкое состояние из газообразного. Кипение — процесс парообразования по всему объёму жидкости (переход вещества из жидкого в газообразное состояние) Кипение начинается при температуре, когда давление в пузырьках становится больше чем давление в жидкости. Насыщенный пар— пар, находящийся в динамическом равновесии с жидкостью (Чем выше давлении тем выше температура т.к.при повышении давления взаимодействие частиц газа увеличивается соответственно возникает сила трения между молекулами и газ сильнее нагревается (ЭТО ВОЗМОЖНО НЕ ПРАВИЛЬНО ЭТО МОЙ ЛИЧНЫЙ ВЫВОД))
