Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа. Температура. Абсолютная температура.
- Идеальный газ –это модель реального газа, силы взаимодействия между молекулами пренебрежимо малы, стремятся к нулю, молекулы – упругие шары.
Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. Идеальным принято считать газ, если:
а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела;
б) газ очень разряжен, т.е. расстояние между молекулами намного больше размеров самих молекул;
в) тепловое равновесие по всему объему достигается мгновенно. Условия, необходимые для того, чтобы реальный газ обрел свойства идеального, осуществляются при соответствующем разряжении реального газа. Некоторые газы даже при комнатной температуре и атмосферном давлении слабо отличаются от идеальных. Основными параметрами идеального газа являются давление, объем и температура.
P = F/S, Манометр показывает давление газа Р0, давление газа на стенки сосуда создается за счет удара молекулы о стенки сосуда.
Р – давление, ( отношение силы к площади поверхности ) Измеряется в Па ( Паскаль ).
На основании использования основных положений молекулярно-кинетической теории было получено основное уравнение МКТ идеального газа: которое выглядит так: 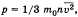 , где р — давление идеального газа, m0 — масса молекулы,
, где р — давление идеального газа, m0 — масса молекулы, 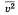 квадрат средней скорости, n – концентрация. 1/3 т.к. трехмерное пространство. Обозначив среднее значение кинетической энергии поступательного движения молекул идеального газа
квадрат средней скорости, n – концентрация. 1/3 т.к. трехмерное пространство. Обозначив среднее значение кинетической энергии поступательного движения молекул идеального газа 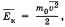
получим основное уравнение МКТ идеального газа в виде: 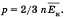
n = N/V N – число частиц, V – объем, ( число частиц в единице объема ).
n – 1/м^3 = м^-3, см^-3 – м^3, 1 см^3 = 1/10^-6 м^3 = 10^6 м^-3.
- Температура –это физическая величина, характеризующая степень нагретости тела ( холодная, теплая, горячая ). Макроскопические параметры: p v T
Тепловые равновесия: 1) состояние системы, при котором p v T сколь угодно долго остаются постоянными.
2) состояние, при котором все тела системы имеют одинаковую температуру.
Тепловое равновесие является следствием теплообмена.
Теплообмен – процесс переноса тепла ( энергии ) от одного тела к другому.
-Абсолютная температура - Единица температуры по абсолютной шкале называется Кельвином и выбрана равной одному градусу по шкале Цельсия 1 К = 1 °С. В шкале Кельвина за ноль принят абсолютный ноль температур, т. е. температура, при которой давление идеального газа при постоянном объеме равно нулю. Вычисления дают результат, что абсолютный нуль температуры равен -273 °С. Таким образом, между абсолютной шкалой температур и шкалой Цельсия существует связь Т = t °C + 273. Абсолютный нуль температур недостижим, так как любое охлаждение основано на испарении молекул с поверхности, а при приближении к абсолютному нулю скорость поступательного движения молекул настолько замедляется, что испарение практически прекращается. Теоретически при абсолютном нуле скорость поступательного движения молекул равна нулю, т. е. прекращается тепловое движение молекул.
T=0К = т=-273 градуса цельсия – абсолютный нуль температуры.
- Уравнение состояния идеального газа. Объединенный газовый закон. Изопроцессы. Газовые законы.




Состояние данной массы газа полностью определено, если известны его давление, температура и объем. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния.
Уравнение Менделеева—Клапейрона показывает, что возможно одновременное изменение трех параметров, характеризующих состояние идеального газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра. Особую роль в физике и технике играют три процесса: изотермический, изохорный и изобарный.
Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
Изотермическим называют процесс, протекающий при постоянной температуре. Т = const. Он описывается законом Бойля—Мариотта: pV = const.
Изохорным называют процесс, протекающий при постоянном объеме. Для него справедлив закон Шарля: V = const, p/T = const.
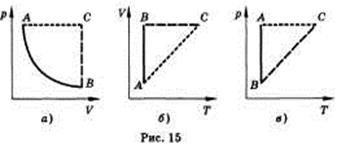
Изобарным называют процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид V/T = const прир = const и называется законом Гей-Люссака. Все процессы можно изобразить графически (рис. 15).
Реальные газы удовлетворяют уравнению состояния идеального газа при не слишком высоких давлениях (пока собственный объем молекул пренебрежительно мал по сравнению с объемом сосуда, в котором находится газ) и при не слишком низких температурах (пока потенциальной энергией межмолекулярного взаимодействия можно пренебречь по сравнению с кинетической энергией теплового движения молекул), т. е. для реального газа это уравнение и его следствия являются хорошим приближением.
