Основные законы химии: закон сохранения массы веществ и закон эквивалентов. Для каких целей используется эти законы?
Вопрос 1.
Основные понятия химии. Количество вещества, моль, молярная масса.
Химия – наука о веществах и их превращениях.Объектом изучения химии являются химические элементы и их соединения.
Атом-простейщая частица вещества ,не делимая .
Молекула-наименьшая частица вещества,обладающая его хим свойствами
Кол-во вещ-ва-равно отношению массы вещ-ва выраженной в гр или кг,к молярной массе вещ-ва
Вещества – различные виды движущейся материи, обладающие массой покоя.
1 моль – количество вещества, содержащее столько формульных единиц сколько атомов содержится в 12-ти граммах изотопа углерода – 12, т.е. 6,02*1023 атомов.
Относительная молекулярная масса – отношение средней массы молекулы к атомной единице массы.
Относительная атомная масса – средняя масса атома элемента, отнесенная к 1 а.е.м.
Молярная масса – масса вещества, деленная на количество вещества. M = m / n
Вопрос 2
Эквиваленты веществ. Эквивалентное число и способы его определения.
Эквивалент- условные или реальные частицы в-ва, в zB раз меньшие, чем соответствующие им формульные единицы.
Закон эквивалентов: Вещества реагируют между собой в отношениях, пропорциональных молярным массам их эквивалентов.
Эквивалентное число Z- это понятие используется для окислит востанов реакций ,которое равно числу электронов присоединенный одной моекулы окислителя или отданных одной молекуле восстановителя.
Числа эквивалентности можно расчитать:
А)для оксидов Z(В)=B*n0; n0-число атомов кислорода
Б)Для оснований Z(В)=кислотности основания
В)для кислот Z(В)=основности кислот
Г)для солей Z(В)=В(ме)*n(Ме); n(Ме)-число катионов металла
Д)для окислителя Z(окисл)=nе nе-число принятых электронов
Е)для восстановителя Z(вост)= nе nе-число отданных электонов
zB- эквивалентное число.zB>=1 числоэквивалентности
fB =1/zB- фактор эквивалентности- величина, обратная числу эквивалентности.
nэк(кол-во в-ва эквивалентов, моль)-физическая величина , пропорциональная числу эквивалентов в-ва, Nэк. ; nэк.в=Zв*Nфе.в
Вопрос 3.
Основные законы химии: закон сохранения массы веществ и закон эквивалентов. Для каких целей используется эти законы?
Закон сохранения массы веществ: общая масса продуктов реакции равна общей массе веществ, вступивших в реакцию.
Закон сохр масс применяется при составлении хим уравнений.Число атомов до и после реакции должно быть одинаково
Закон эквивалентности-вещ-ва реагируют между собой в отношениях пропорциональным молярным массам их эквивалентов.
Закон эквивалентов устанавливает количесвенное соотношение веществ в хим.реакции .
Нашел применение лишь в химико-аналитич практике
Вопрос 4
Закон Авогадро и следствия из него. Для каких целей используются эти слдествия?
Закон Авогадро: в равных объёмах различных газов при одинаковых давлении и температуре содержится одинаковое число частиц или формульных единиц.
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём.
В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm=V/n
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму. M1/M2=D
Вопрос 5.
Вопрос 6.
Основные понятия химической термодинамики: система, свойства системы, тпелота, работа и внутренняя энергия.
Система – тело или группа тел, находящихся во взаимодействии и либо мысленно, либо реально обособляемые от окружающей среды.
Различают: изолированные (нет обмена), закрытые (обмен энергией), открытые (обмен энергией и веществом).
Внутренняя энергия – термодинамическая величина, являющаяся функцией состояния системы.
Теплота (Q) - энергия, которая передаётся одной системой другой при их взаимодействии, зависящая только от температур этих систем.
Работа (A) - энергия, передаваемая одной системой другой, зависящая от наличия силового поля или внешнего давления, под действием которого система меняет свой объём. В последнем случае говорят о работе сил расширения.
Свойства системы в физической химии могут быть описаны заданием параметров системы. В качестве параметров чаще всего выступают температура (Т), давление (Р), объём (V), количество вещества (н) и другие. Если параметры системы постоянны, говорят, что система находится в состоянии равновесия.
Вопрос 7.
Первый закон термодинамики. Энтальпия системы. Стандартная теплота образования простых и сложных веществ. Единицы измерения.
Первый закон термодинамики.
Внутренняя энергия может изменяться только под влиянием внешних воздействий, то есть в результате сообщения системе количества теплоты Q и совершения над ней работы (- А):
Q=dU+W W-работа
Энтропия – это мера неупорядоченности состояния системы; стремление частиц (молекул, ионов, атомов) к хаотическому движению. По изменению энтропии в ходе реакции можно судить о переходе системы от более упорядоченного состояния к менее упорядоченному или наоборот.
Энтропия возрастает (∆Ѕ>0) с увеличением движения частиц при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п.
Процессы, связанные с упорядоченностью системы (конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация), сопровождаются уменьшением энтропии (∆Ѕ < 0). Измеряется энтропия в Дж/моль×К.
Изменение энтропии системы в результате протекания химической реакции (∆S) (энтропия реакции) равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом стехиометрических коэффициентов.Изменение энтропии в результате протекания химической реакции
aA + bB = сС + dD:
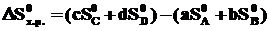 .
.
Энтальпия системы (от греч. enthalpo нагреваю) – это однозначная функция H состояния термодинамической системы при независимых параметрах энтропии S и давлении P, которая связана с внутренней энергией U соотношением H = U + PV, где V – объем системы.
Из закона сохранения энергии следует, что, когда вещество образуется из атомов и (или) более простых веществ, внутренняя энергия или энтальпия системы меняется на определенную величину, называемую теплотой образования данного вещества.
Вопрос 8.
Вопрос 9
Закон Гесса и следствия из него. Стандартные энтальпии образования и сгорания простых и сложных веществ.
Тепловой эффект химических р-ции 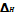 (энтальпии р-ции)-изменение энергии системы при протекании в ней химической реакции при условии, что система не совершает никакой другой работы, кроме работы расширения.
(энтальпии р-ции)-изменение энергии системы при протекании в ней химической реакции при условии, что система не совершает никакой другой работы, кроме работы расширения.
Закон Гесса:тепловой эффект протекающий при постоянном давлении или постоянном объёме, не зависит от пути протекания реакции и определяется только природой и состоянием исходных в-в и конечных продуктов.
Первое следствие из закона Гесса: Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных в-в.
Энтальпия образования в-ва ( 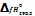 ):это энтальпия р-ции образования 1 моль соединения из простых в-в, устойчивых при стандартных условиях.
):это энтальпия р-ции образования 1 моль соединения из простых в-в, устойчивых при стандартных условиях.
Общий вид: aA+bB=dD+eE
Энтальпия образования простых веществ при стандартных условиях принята равной нулю.
Второе следствие из закона Гесса: энтальпия химической реакции равна сумме энтальпий сгорания исходных в-в за вычетом суммы энтальпий сгорания продуктов.
Энтальпия сгорания в-ва( 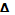 c
c 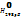 )-это энтальпия реакции окисления кислородом 1 моль соединения до образования высших оксидов.
)-это энтальпия реакции окисления кислородом 1 моль соединения до образования высших оксидов.
Вопрос 10
Вопрос 11
Вопрос 12.
Вопрос 13
Вопрос 14
Состояние термодинамического равновесия. Константа равновесия. Использование уравнения изотермы Вант-Гоффа для определения возможности осуществления химических реакций.
Термодинамическое равновесие — состояние системы, при котором ее параметры (температура, давление, объем, энтропия) остаются неизменными по времени в условиях изолированности от окружающей среды.
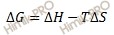
Отсюда при термодинамическом равновесии должно выполниться соотношение:
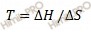
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия.
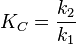
Например, для реакции окисления монооксида углерода:
2CO + O2 = 2CO2константа равновесия может быть рассчитана по уравнению:
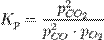
Правило Вант-Гоффа При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
Уравнение, которое описывает это правило, следующее:
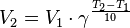
где 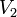 — скорость реакции при температуре
— скорость реакции при температуре 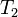 ,
, 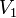 — скорость реакции при температуре
— скорость реакции при температуре 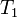 ,
, 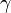 — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
Изотерма химической реакции (изотерма Вант-Гоффа)При самопроизвольном протекании химической реакции изменение свободной энергии системы отлично от нуля (ΔG < 0, ΔF < 0). Т.о., для самопроизвольного процесса можно записать:
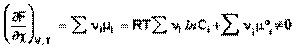 (39)
(39)
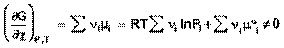 (40)
(40)
При протекании реакции в большом количестве реакционной смеси, таком, что при превращении ni молей каждого из компонентов концентрации реагентов Сi практически не изменяются, частную производную свободной энергии Гельмгольца по химической переменной можно заменить равной ей величиной отношения ΔF к Δχ, т.е. принять, что
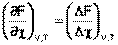
Положив Δχ = 1, получаем
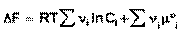 (41)
(41)
Поскольку, как следует из (35,37), 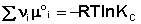 , окончательно получаем уравнение, называемое изотермой химической реакции (изотермой Вант-Гоффа):
, окончательно получаем уравнение, называемое изотермой химической реакции (изотермой Вант-Гоффа):
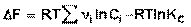 (42)
(42)
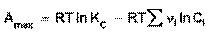 (43)
(43)
Для изобарно-изотермического процесса аналогичным образом можно получить:
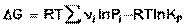 (44)
(44)
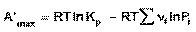 (45)
(45)
Уравнение изотермы Вант-Гоффа позволяет рассчитать максимальную работу химической реакции и тем самым определить возможность её самопроизвольного протекания в каких-либо конкретных условиях (при температуре Т и концентрациях реагентов Ci или парциальных давлениях Pi).
Вопрос 15
Вопрос 16
Вопрос 17
Вопрос 18
Вопрос 19
Увеличивают скорость
1. Наличие химически активных реагентов
2.Повышение концентрации реагентов
3.Увеличение поверхности твердых и жидких реагентов
4.Повышение температуры
5.Присутствие катализатора
Уменьшают скорость
- Наличие химически неактивных реагентов
- Понижение концентрации реагентов
- Уменьшение поверхности твердых и жидких реагентов
- Понижение температуры
- Присутствие ингибитора
Вопрос 20
Вопрос 21
Вопрос 22
Вопрос 23
Вопрос 24
Вопрос 25
Периодический закон. В чем причина периодичности изменения свойств элементов с увеличением заряда ядра? Короткопериодный вариант ПСЭ.
Свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от q ядер их атомов. Период-последовательный ряд элементов, размещённых в порядке ↑q атомов, электронная конфигурация кот изменяется от ns1 до ns2np6 (или до ns2 у первого периода). Периоды начинаются с s-элемента и заканчиваются р-элементом (у 1-го периода-s-элементом). Малые периоды содержат по 2 и 8 элементов, большие-18 и 32, 7 период не завершён. Каждый период, кроме 1, начинается щелочным металлом и заканчивается благородным газом. В ПСХЭ имеется 8 групп, что соответствует max числу е во внешних подоболочках. Номер группы связан со степенью окисления элементов, проявляемой ими в соединениях. Группы делятся на главные и побочные. Подгруппы включают в себя элементы с аналогичными электронными структурами. К главным подгруппам (А) относятся подгруппы элементов второго периода: Li,Be,B,C,N,O,F и подгруппа благородных газов. К побочным (В) принадлежат d- и f-элементы. Первые шесть d-элементов (от Sc до Fe) начинают соответствующие подгруппы от подгр. III (Sc) до подгр.VIII (Fe). В подгр. VIII также включаются все элементы семейства железа (Fe, Co, Ni) и их аналоги-платиновые металлы. Медь и ее аналоги, имеющие во внешней s-оболочке по 1е, образуют первую побочную подгруппу. Лантаноиды и актиноиды (f-элементы) называют семейством и не относят к какой-л группе. Хим свойства элементов главных и побочных групп значительно различаются. Н-р, в VII группе главную подгруппу составляют неметаллы F,Cl,Br,I,At, побочную-металлы Мn,Tc,Re. Т.о., подгруппы объединяют наиболее сходные м/у собой элементы. Свойства элементов в подгруппах закономерно изменяются: сверху вниз усиливаются металлические свойства и ослабевают неметаллические.
Вопрос 26
Вопрос 27
Вопрос 28
Вопрос 29
Теория гибридизации. Атом бора имеет один неспареныый электрон, но способен образовывать соединения типа BH3. Почему? Какой тип гибридизации реализуется в этом соединении?
Атом бора имеет один неспаренный электрон, но способен образовывать соединение типа ВН3. Почему? Какой тип гибридизации реализуется в этом соединении и какое строение оно имеет?
При образовании химической связи атом может переходить в т.н. возбужденное состояние. В этом состоянии происходит образование неспаренных электронов из спаренных. Процесс сопровождается переходом половины образовавшихся холостых электронов на вакантные орбитали того же уровня.
В соответствии с электронной структурой атома (1s22s22p1) бор может быть одновалентным (один неспаренный электрон на энергетическом 2р-подуровне). Однако для бора наиболее характерны соединения, в которых он трехвалентен (при возбуждении атома три неспаренных электрона в энергетических 2s- и 2р-подуровнях).
Свободная 2р-орбиталь в возбужденном атоме бора обусловливает акцепторные свойства многих его соединений, в которых три ковалентные связи образованы по обменному ковалентному механизму (например, ВBr3). Эти соединения склонны к присоединению частиц с электронно-донорными свойствами, т. е. к образованию еще одной ковалентной связи по донорно-акцепторному механизму.
В соединениях с неметаллами степень окисления бора +3; все эти соединения ковалентны.
Простейшее соединение бора с водородом ВН3 в обычных условиях не существует, sp2-Гибридизация электронных орбиталей в атоме бора приводит к координационной ненасыщенности частицы ВНз, вследствие чего происходит объединение двух таких частиц в молекулу диборана: 2ВНз = В2Н6 (ΔG0298 = -127 кДж/моль).
В диборане В2Н6 бор находится в состоянии 5р3-гибридизации, причем у каждого атома бора одна из четырех гибридных орбиталей пуста, а три другие перекрыты s-орбиталями атомов водорода. Связи между группами ВНз в молекуле В2Н6 образуются по типу водородной связи за счет смещения электронной плотности от одного атома водорода группы ВНз к
Вопрос 30
Ионная химическая сзвязь. Механизм образования и характерные особенности ионной связи.
Ионная химическая связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Такая связь возникает лишь в случае большой разности ЭО атомов, например между катионами s-металлов первой и второй групп периодической системы и анионами неметаллов 6 и 7 групп (LiF, CsCl, K2O и др.)
Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и хлором. Атом щелочного металла легко теряет электрон, а атом галогена - приобретает. В результате этого возникает катион натрия и хлорид-ион. Они образуют соединение за счет электростатического притяжения между ними.
Т. к. электрическое поле иона имеет сферический характер, для ионной химической связи не характерна направленность. Ионной связи так же не свойственна насыщаемость, т к ион способен взаимодействовать со многими соседними ионами противоположного знака, число которых зависит от зарядов ионов и соотношений геометрических размеров. Ионная химическая связь проявляется в твердых веществах с ионной кристаллической решеткой. Т к энергия ионизации больше энергии сродства к электрону, то полного перехода электронов не происходит даже в случае пары атомов с большой разностью ЭО. Поэтому и чисто ионная связь не существует. Можно лишь говорить о доле ионности связи.
Вопрос 1.
Основные понятия химии. Количество вещества, моль, молярная масса.
Химия – наука о веществах и их превращениях.Объектом изучения химии являются химические элементы и их соединения.
Атом-простейщая частица вещества ,не делимая .
Молекула-наименьшая частица вещества,обладающая его хим свойствами
Кол-во вещ-ва-равно отношению массы вещ-ва выраженной в гр или кг,к молярной массе вещ-ва
Вещества – различные виды движущейся материи, обладающие массой покоя.
1 моль – количество вещества, содержащее столько формульных единиц сколько атомов содержится в 12-ти граммах изотопа углерода – 12, т.е. 6,02*1023 атомов.
Относительная молекулярная масса – отношение средней массы молекулы к атомной единице массы.
Относительная атомная масса – средняя масса атома элемента, отнесенная к 1 а.е.м.
Молярная масса – масса вещества, деленная на количество вещества. M = m / n
Вопрос 2
Эквиваленты веществ. Эквивалентное число и способы его определения.
Эквивалент- условные или реальные частицы в-ва, в zB раз меньшие, чем соответствующие им формульные единицы.
Закон эквивалентов: Вещества реагируют между собой в отношениях, пропорциональных молярным массам их эквивалентов.
Эквивалентное число Z- это понятие используется для окислит востанов реакций ,которое равно числу электронов присоединенный одной моекулы окислителя или отданных одной молекуле восстановителя.
Числа эквивалентности можно расчитать:
А)для оксидов Z(В)=B*n0; n0-число атомов кислорода
Б)Для оснований Z(В)=кислотности основания
В)для кислот Z(В)=основности кислот
Г)для солей Z(В)=В(ме)*n(Ме); n(Ме)-число катионов металла
Д)для окислителя Z(окисл)=nе nе-число принятых электронов
Е)для восстановителя Z(вост)= nе nе-число отданных электонов
zB- эквивалентное число.zB>=1 числоэквивалентности
fB =1/zB- фактор эквивалентности- величина, обратная числу эквивалентности.
nэк(кол-во в-ва эквивалентов, моль)-физическая величина , пропорциональная числу эквивалентов в-ва, Nэк. ; nэк.в=Zв*Nфе.в
Вопрос 3.
Основные законы химии: закон сохранения массы веществ и закон эквивалентов. Для каких целей используется эти законы?
Закон сохранения массы веществ: общая масса продуктов реакции равна общей массе веществ, вступивших в реакцию.
Закон сохр масс применяется при составлении хим уравнений.Число атомов до и после реакции должно быть одинаково
Закон эквивалентности-вещ-ва реагируют между собой в отношениях пропорциональным молярным массам их эквивалентов.
Закон эквивалентов устанавливает количесвенное соотношение веществ в хим.реакции .
Нашел применение лишь в химико-аналитич практике
Вопрос 4
