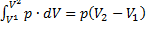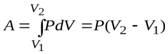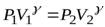Адиабатический процесс. Работа идеального газа в изопроцессах и в адиабатическом процессе.
Адиабатический процесс. Работа идеального газа в изопроцессах и в адиабатическом процессе.
Работа, совершаемая газом при изопроцессах
Изобарный  .
.
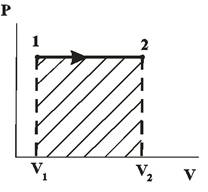 | Диаграмма этого процесса (изобары) в координатах  изображается прямой, параллельной оси изображается прямой, параллельной оси  (рис. 14.2). При изобарном процессе работа газа при расширении объёма от (рис. 14.2). При изобарном процессе работа газа при расширении объёма от  до до  равна: равна:
| |
| Рис. 14.2 |
И определяется площадью заштрихованного прямоугольника на рис. 14.2.
Изохорный процесс (  ). Диаграмма этого процесса
). Диаграмма этого процесса
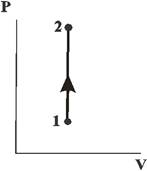 | (изохора) в координатах 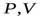 изображается прямой, параллельной оси ординат (рис. 14.3).поскольку изображается прямой, параллельной оси ординат (рис. 14.3).поскольку 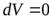 , то , то  . Изотермический процесс ( . Изотермический процесс ( 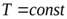 ). (рис. 14.4). Воспользовавшись уравнением состояния идеального газа Менделеева-Клайперона для работы в изотермическом процессе получаем: ). (рис. 14.4). Воспользовавшись уравнением состояния идеального газа Менделеева-Клайперона для работы в изотермическом процессе получаем: | ||
| Рис. 14.3 | |||
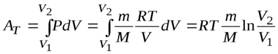 | |||
Изотермический процесс является идеальным процессом, т.к. расширение газа при постоянной температуре может происходить только бесконечно медленно. При конечной скорости расширения возникнут градиенты температуры.
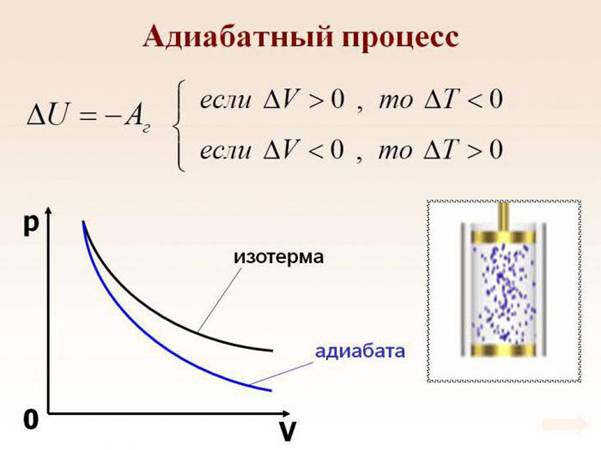
4. Адиабатический (адиабатный) процесс
Это процесс, происходящий без теплообмена с окружающими телами. Рассмотрим, при каких условиях можно реально осуществить адиабатический процесс, или приблизиться к нему.
1. Необходима адиабатическая оболочка, теплопроводность которой равна нулю. Приближением к такой оболочке может служить сосуд Дьюара.
2. 2-ой случай – процессы, протекающие очень быстро. Теплота не успевает распространиться и в течение некоторого времени можно полагать 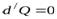 .
.
3. Процессы, протекающие в очень больших объёмах газа, например, в атмосфере (области циклонов, антициклонов). Для выравнивания температуры передача теплоты должна происходить из соседних, более нагретых слоёв воздуха, на это часто требуется значительное время.
Для адиабатического процесса первый закон термодинамики:
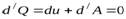
или 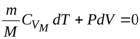 .
.
В случае расширения газа 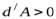 ,
, 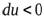 , (температура понизится). Если произошло сжатие газа
, (температура понизится). Если произошло сжатие газа  , то
, то 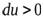 (температура повышается). Выведем уравнение, связывающее параметры газа при адиабатическом процессе. Учтём, что для идеального газа
(температура повышается). Выведем уравнение, связывающее параметры газа при адиабатическом процессе. Учтём, что для идеального газа  , тогда
, тогда

Разделим обе части уравнения на 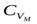 :
:
 .
.
Из уравнения Майера  , тогда
, тогда
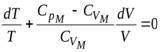 .
.
Обозначим  .
.
 .
.
Проинтегрируем это уравнение:
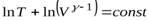 |
Отсюда
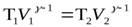
Получили уравнение Пуассона (для адиабаты) (1 – ая форма). Заменим  :
:
 ,
,
 | т.к. для данной массы газа  величина постоянная, то величина постоянная, то 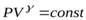
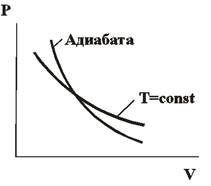
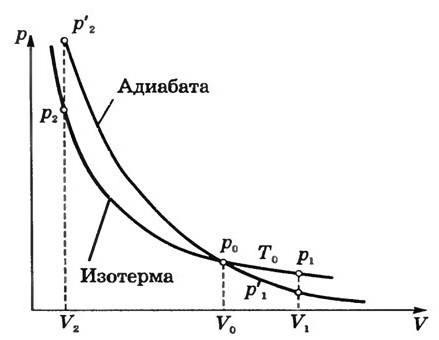
2 – ая форма уравнения Пуассона. На рис. 14.5 представлены сравнительные графики изотермы и адиабаты. | |
| Рис. 14.5 |
Так как  , то график адиабаты более крутой по сравнению с изотермой. Вычислимработу при адиабатическом процессе:
, то график адиабаты более крутой по сравнению с изотермой. Вычислимработу при адиабатическом процессе:
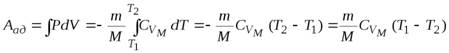
т.е 
Политропические процессы.
Так называют процессы, уравнение которых в переменных  имеет вид
имеет вид
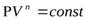
где n-произвольное число, как положительное, так и отрицательное, а также равное нулю. Соответствующую кривую называют политропой. Политропическими являются, в частности, процессы адиабатический, изотермический, изобарический, изохорический.
Вопросы для самоконтроля
1. Чем термодинамический метод исследования свойств систем отличается от молекулярно-кинетического?
2. Какую часть энергии системы называют внутренней?
3. Как определяется работа в термодинамике?
4. Что называется количеством теплоты?
5. Какая из величин А, Q,U является функцией состояния термодинамической системы? Почему?
6. Сформулируйте первое начало термодинамики.
7. Запишите первое начало термодинамики для всех известных вам изопроцессов идеального газа.
8. Что такое теплоемкость тела? Чем отличаются удельная и молярная теплоемкости?
9. Чему равна теплоемкость для каждого изопроцесса? Почему теплоемкость 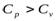 ?
?
10. Получите выражение для работы в каждом процессе. При каком изо- процессе не совершается работа?
11. Какой процесс называется адиабатным? Как можно осуществить процесс, близкий к адиабатному?
12. Проделайте вывод уравнения Пуассона для адиабатного процесса.
13. Адиабатический процесс - это такое изменение состояний газа, при котором он не отдает и не поглощает извне теплоты. Следовательно, адиабатический процесс характеризуется отсутствием теплообмена газа с окружающей средой. Адиабатическими можно считать быстро протекающие процессы. Так как передачи теплоты при адиабатическом процессе не происходит, то 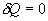 и уравнение I начала термодинамики принимает вид
и уравнение I начала термодинамики принимает вид
 | (9.20) |
14. или 
15. т.е. внешняя работа газа может производиться вследствие изменения его внутренней энергии. Адиабатное расширение газа (dV>0) сопровождается положительной внешней работой, но при этом внутренняя энергия уменьшается и газ охлаждается (dT<0).
16. Сжатие газа (dV0, т.е. адиабатное сжатие газа сопровождается его нагреванием.
17. Найдем связь между параметрами состояния идеального газа (например, Р и V) в адиабатическом процессе. Для этого перепишем (9.20) в форме
18. 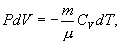
19. а величину 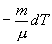 найдем из уравнения Менделеева - Клапейрона
найдем из уравнения Менделеева - Клапейрона
20.  Таким образом,
Таким образом, 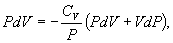 или, учитывая, что для идеального газа
или, учитывая, что для идеального газа 
 Разделим обе части этого уравнения на
Разделим обе части этого уравнения на 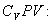
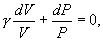
21. где  безразмерная величина, называемая постоянной адиабаты. Пренебрегая зависимостью
безразмерная величина, называемая постоянной адиабаты. Пренебрегая зависимостью 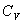 от температуры, можно считать, что для данного газа
от температуры, можно считать, что для данного газа 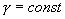 . Интегрируя последнее уравнение
. Интегрируя последнее уравнение
22. 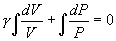 получим
получим  т.е.
т.е.
 | (9.21) |
23. Это выражение называют уравнением Пуассона. Соотношение между давлением и температурой, а также между объемом и температурой идеального газа в адиабатическом процессе имеют вид
24. 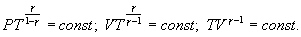
25. Эти соотношения легко получить из (9.21), пользуясь уравнением Менделеева - Клапейрона. Линию, изображающую адиабатический процесс в диаграмме состояния, называют адиабатой. На рис. 9.7 сплошной линией показан вид адиабаты в (P-V) диаграмме. Для сравнения в том же рисунке пунктирной линией изображена изотерма, соответствующая температуре газа в начальном состоянии 1. Так как для любого идеального газа показатель адиабаты 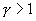 , то в (P-V) диаграмме адиабата всегда идет круче, чем изотерма. Объясняется это тем, что при адиабатическом сжатии увеличение давления обусловлено не только уменьшением объема газа, как при изотермическом сжатии, то также еще и увеличения температуры. При адиабатическом расширении температура газа уменьшается, поэтому давление газа падает быстрее, чем при изотермическом расширении.
, то в (P-V) диаграмме адиабата всегда идет круче, чем изотерма. Объясняется это тем, что при адиабатическом сжатии увеличение давления обусловлено не только уменьшением объема газа, как при изотермическом сжатии, то также еще и увеличения температуры. При адиабатическом расширении температура газа уменьшается, поэтому давление газа падает быстрее, чем при изотермическом расширении.
26. 
27. Работу, совершаемую газом в адиабатическом процессе, найдем интегрируя выражение
28.  Полная работа
Полная работа 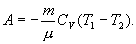
29. Из уравнения Майера (9.18) и выражения 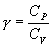 для показателя адиабаты γ следует, что
для показателя адиабаты γ следует, что
30. 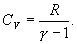
31. Поэтому
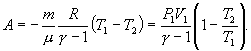 | (9.22) |
32. В соответствии с соотношением 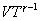
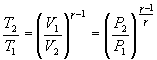
33. Следовательно, выражение (9.22) для работы можно представить в виде
34.  или
или 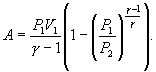
35. .6. Политропический процесс
36. В параграфе 2.4 отмечалось, что важным классом термодинамических процессов являются процессы, происходящие при постоянной теплоемкости, то есть политропические процессы. К таким процессам, в частности, относятся адиабатический, изотермический, изобарический и изохорический процессы.
37. Для идеального газа нетрудно получить уравнение политропического процесса тем же способом, которым ранее было выведено уравнение Пуассона. Пусть молярная теплоёмкость идеального газа в политропическом процессе равна 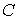 . Тогда в соответствии с первым началом термодинамики (1.5) имеем выражение:
. Тогда в соответствии с первым началом термодинамики (1.5) имеем выражение:
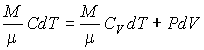 , , | (2.99) |
38. из которого следует:
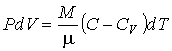 . . | (2.100) |
39. Подставляя это выражение в формулу (2.76) получим
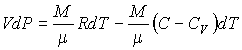 | (2.101) |
40. или с учетом соотношения Майера (2.70)
 . . | (2.102) |
41. Сравнение формул (2.100) и (2.102) при условии, что 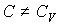 , позволяет записать уравнение
, позволяет записать уравнение
 , , | (2.103) |
42. аналогичное уравнению (2.79). Здесь введен параметр
 , , | (2.104) |
43. который называется показателем политропы.
44. Из этой формулы можно также получить зависимость молярной теплоемкости 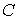 от показателя политропы
от показателя политропы 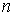 :
:
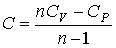 . . | (2.105) |
45. Преобразование формулы (2.103) к виду:
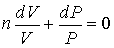 | (2.106) |
46. и интегрирование полученного уравнения дает
 . . | (2.107) |
47. Уравнение (2.107) называется уравнением политропического процесса или политропы – кривой, описываемой таким уравнением в переменных 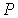 и
и 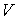 .
.
48. Аналогично уравнениям адиабаты (2.86) и (2.87) уравнение политропы может быть переписано в других термодинамических координатах:
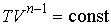 , , | (2.108) |
49.
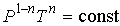 . . | (2.109) |
50. При адиабатическом процессе  , что соответствует нулевой теплоемкости. Подставив
, что соответствует нулевой теплоемкости. Подставив 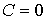 в формулу (2.104) и сравнив получившееся выражение с (2.80), имеем
в формулу (2.104) и сравнив получившееся выражение с (2.80), имеем  , и уравнение политропы (2.107) становится уравнением адиабаты:
, и уравнение политропы (2.107) становится уравнением адиабаты:  .
.
51. Если процесс изотермический, то  , так как при этом
, так как при этом 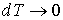 . В этом случае показатель политропы
. В этом случае показатель политропы 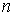 в пределе равен единице, и уравнение политропы (2.107) преобразуется в уравнение Бойля-Мариотта (2.11):
в пределе равен единице, и уравнение политропы (2.107) преобразуется в уравнение Бойля-Мариотта (2.11): 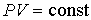 . Обратим внимание на то, что поскольку при выводе уравнения политропы мы исключали величину
. Обратим внимание на то, что поскольку при выводе уравнения политропы мы исключали величину 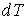 , то этот вывод не может считаться полностью корректным для изотермического процесса.
, то этот вывод не может считаться полностью корректным для изотермического процесса.
52. Для изобарического процесса при 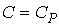 показатель политропы
показатель политропы  , и уравнение (2.107) принимает форму:
, и уравнение (2.107) принимает форму:  .
.
53. При изохорическом процессе 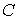 должно стать равным
должно стать равным 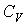 , что соответствует случаю, когда показатель
, что соответствует случаю, когда показатель  . Очевидно, переход в формуле (2.107) к указанному пределу некорректен. Это связано с тем, что при выводе уравнения политропы предполагалось, что
. Очевидно, переход в формуле (2.107) к указанному пределу некорректен. Это связано с тем, что при выводе уравнения политропы предполагалось, что 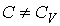 (см. переход к формуле (2.103)).
(см. переход к формуле (2.103)).
54. Если умножить уравнение (2.100) на величину 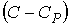 и сложить его с уравнением (2.102), предварительно умноженным на величину
и сложить его с уравнением (2.102), предварительно умноженным на величину 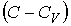 , то получим уравнение политропы в дифференциальном виде
, то получим уравнение политропы в дифференциальном виде
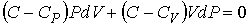 . . | (2.110) |
55. При 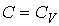 это уравнение приобретает форме:
это уравнение приобретает форме:
 | (2.111) |
56. Отсюда имеем 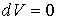 или
или  . Из уравнения (2.110) также следует, что в процессе, при котором
. Из уравнения (2.110) также следует, что в процессе, при котором 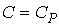 , давление постоянно:
, давление постоянно:  .
.
57. Для политропических процессов значение теплоёмкости и, соответственно, показателя политропы могут принимать любые величины. Отрицательные значения теплоёмкости, когда показатель политропы 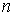 принимает значения от единицы до величины g (см. формулу (2.105)), соответствуют таким условиям, при которых внутренняя энергия термодинамической системы убывает при передаче ей положительного количества теплоты. Это может быть осуществлено при принудительном расширении газа.
принимает значения от единицы до величины g (см. формулу (2.105)), соответствуют таким условиям, при которых внутренняя энергия термодинамической системы убывает при передаче ей положительного количества теплоты. Это может быть осуществлено при принудительном расширении газа.
58. В соответствии с формулой (2.100) при 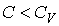 величины
величины 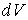 и
и 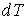 имеют различные знаки, и с ростом объёма газа его температура, а, следовательно, и внутренняя энергия, уменьшаются. С этим, в частности, связано понижение температуры идеального газа при его адиабатическом расширении, так как в этом процессе
имеют различные знаки, и с ростом объёма газа его температура, а, следовательно, и внутренняя энергия, уменьшаются. С этим, в частности, связано понижение температуры идеального газа при его адиабатическом расширении, так как в этом процессе 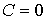 . Наоборот, при
. Наоборот, при  с ростом объёма газа его температура растёт. В соответствии с первым началом термодинамики этот рост должен быть обеспечен подводом к системе дополнительного количества теплоты.
с ростом объёма газа его температура растёт. В соответствии с первым началом термодинамики этот рост должен быть обеспечен подводом к системе дополнительного количества теплоты.
59. Рассуждая аналогичным образом, можно на основании формулы (2.102) установить связь между приращениями давления и температуры. При  с ростом давления температура газа будет возрастать, а при
с ростом давления температура газа будет возрастать, а при  - уменьшаться.
- уменьшаться.
60. Работа газа в политропическом процессе может быть определена с помощью интеграла (1.13) при подстановке в него уравнения политропы(2.107), аналогично тому, как это сделано в формуле (2.97):
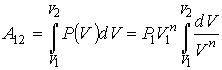 . . | (2.112) |
61. Интегрирование в выражении (2.112) дает формулу для определения работы в политропическом процессе
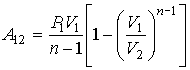 , , | (2.113) |
62. где: 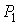 и
и  - начальные давление и объём газа,
- начальные давление и объём газа, 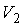 - его конечный объём.
- его конечный объём.
63. Из этой формулы, в частности, следует, что работа при расширении газа всегда остаётся положительной, независимо от того, какое значение принимает показатель политропы, больше или меньше единицы.
64. Нетрудно видеть, что для адиабатического процесса при  выражение (2.113) переходит в формулу (2.95). Для изобарического процесса, при
выражение (2.113) переходит в формулу (2.95). Для изобарического процесса, при  , выражение (2.113) дает
, выражение (2.113) дает
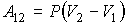 , , | (2.114) |
65. где учтено, что при этом процессе 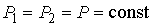 .
.
66. Формула (2.113) неприменима для описания изохорического процесса, так как при выводе уравнения политропы (2.103) исключался случай 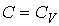 . Но из формулы (2.100) очевидно, что работа газа в изохорическом процессе равна нулю.
. Но из формулы (2.100) очевидно, что работа газа в изохорическом процессе равна нулю.
67. Другим процессом, не описывающимся соотношением (2.113), является изотермический процесс. Как было сказано выше, он является предельным случаем политропического процесса при  . Работу в изотермическом процессе можно найти, если в формулу (2.112) в соответствии с законом Бойля-Мариотта подставить
. Работу в изотермическом процессе можно найти, если в формулу (2.112) в соответствии с законом Бойля-Мариотта подставить 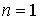 , а затем выполнить интегрирование. Тогда имеем
, а затем выполнить интегрирование. Тогда имеем
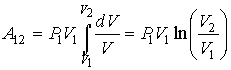 | (2.115) |
68. или
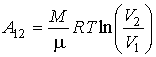 , , | (2.116) |
69. где учтено постоянство температуры в этом процессе: 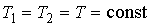 .
.
70. Поскольку внутренняя энергия идеального газа не изменяется в изотермическом процессе, количество теплоты, полученное газом, также может быть рассчитано по этой формуле, то есть в этом процессе  . При изотермическом расширении идеального газа работа совершается только за счёт теплоты, подведённой из окружающей среды.
. При изотермическом расширении идеального газа работа совершается только за счёт теплоты, подведённой из окружающей среды.
71. В заключение параграфа запишем все полученные формулы в единую таблицу 2.1.
| Термодинамический процесс | Показательполитропы | Теплоемкость | Работа |
| Изотермический |  |  | |
| Изобарический | 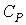 | 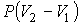 | |
| Изохорический | 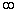 | 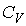 | |
| Адиабатический |  | 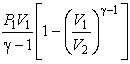 |
72. Задача 2.4. Какова молярная теплоёмкость 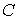 одноатомного газа и показатель политропы
одноатомного газа и показатель политропы 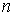 для процесса, в котором работа, совершаемая газом, в два раза превосходит количество теплоты, передаваемое ему?
для процесса, в котором работа, совершаемая газом, в два раза превосходит количество теплоты, передаваемое ему?
73. Решение: Так как по условию задачи  , то в соответствии с первым началом термодинамики имеем:
, то в соответствии с первым началом термодинамики имеем:
74. 
75. или
76. 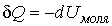 .
.
77. Тогда, с учетом одноатомности газа (число степеней свободы 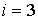 ), молярную теплоемкость можно определить по формуле:
), молярную теплоемкость можно определить по формуле:
78. 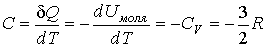 ,
,
79. а показатель политропы соответственно будет равен:
80. 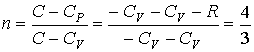
81. Задача 2.5. Какая работа совершается одним молем идеального газа в политропическом процессе с показателем политропы 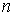 при изменении температуры газа на
при изменении температуры газа на 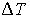 ?
?
82. Решение: Используя уравнение политропы (2.108):  и уравнение Клапейрона-Менделеева для одного моля
и уравнение Клапейрона-Менделеева для одного моля 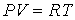 , перепишем (2.113) в виде:
, перепишем (2.113) в виде:
83.  .
.
84. Отсюда имеем:
85. 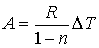 .
.
86. Следовательно, работа, совершаемая одном молем идеального газа в процессе с постоянной теплоёмкостью, определяется только разностью температур конечного и начального состояний газа.
87. Таким образом, для идеального газа работа, а, следовательно, и количество теплоты, в политропических процессах определяются только конечным и начальным состояниями системы, так как путь перехода из одного состояния в другое определён теплоёмкостью газа (показателем политропы). Однако даже при рассмотрении только политропических процессов, работу и количество теплоты нельзя считать функцией состояния системы, так как переход из одного состояния в другое может быть осуществлен последовательностью различных политропических процессов.
88. Задача 2.6. Какое количество теплоты передано одноатомному газу в процессе, описанному в условии задачи 2.5?
89. Решение: В соответствии с формулой (2.105) имеем:
90. 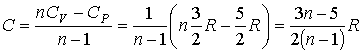 .
.
91. Тогда количество теплоты будет равно:
92. 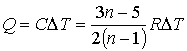 .
.
93. Отсюда, в частности, следует, что при равенстве показателя политропы показателю адиабаты для одноатомного газа:  , количество теплоты
, количество теплоты 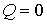 .
.
94. Работа идеального газа в изопроцессах.
95. Первый закон термодинамики (закон сохранения энергии для тепловых процессов) определяет количественное соотношение между изменением внутренней энергии системы дельта U, количеством теплоты Q, подведенным к ней, и суммарной работой внешних сил A, действующих на систему.
96. Первый закон термодинамики - Изменение внутренней энергии системы при ее переходе из одного состояния в другое равно сумме количества теплоты, подведенного к системе извне, и работы внешних сил, действующих на нее:
97. 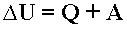
98. Первый закон термодинамики - количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
99. 
100. Частные случаи первого закона термодинамики для изопроцессов
101. При изохорном процессе объем газа остается постоянным, поэтому газ не совершает работу. Изменение внутренней энергии газа происходит благодаря теплообмену с окружающими телами:
102. 
103. При изотермическом процессе количество теплоты, переданное газу от нагревателя, полностью расходуется на совершение работы:
104. Q=A'
105. При изобарном расширении газа подведенное к нему количество теплоты расходуется как на увеличение его внутренней энергии и на совершение работы газом:
106. 
107. Адиабатный процесс - термодинамический процесс в теплоизолированной системе.
108. 
109. Адиабатический процесс.
110. Адиабатический процесс — термодинамический процесс в макроскопической системе, при котором система не получает и не отдаёт тепловой энергии.
111. Для адиабатического процесса первое начало термодинамики в силу отсутствия теплообмена системы со средой имеет вид:  ,
,  - изменение внутренней энергии тела, A - работа, совершаемая системой
- изменение внутренней энергии тела, A - работа, совершаемая системой
112. Политропический процесс.
113. Политропный процесс — термодинамический процесс, во время которого удельная теплоёмкость c газа остаётся неизменной. Предельными частными явлениями политропного процесса являются изотермический процесс и адиабатный процесс. В случае идеального газа изобарный процесс и изохорный процесс также являются политропическими.
114. Для идеального газа уравнение политропы может быть записано в виде:
115. pVn = const ,где величина 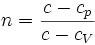 называется показателем политропы.
называется показателем политропы.
Работа идеального газа при изопроцессах
 Вычислим работу идеального газа при различныхизопроцессах в соответствии с её определением
Вычислим работу идеального газа при различныхизопроцессах в соответствии с её определением
А= 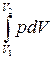 . (5)
. (5)
1. Изотермический процесс.
Подставив в (5) выражение р из уравнения pV=νRT0, получаем:
 .
.
 2. Изохорный процесс. Так как здесь V=const, тоА=0.
2. Изохорный процесс. Так как здесь V=const, тоА=0.
3. Изобарный процесс. Так как здесь р=const=р0, то  .
.
4. Адиабатный процесс.
Так как здесь Q=0. то работа газа совершается только за счёт его внутренней энергии:
А=Q−ΔU=−ΔU=−νCVΔT=νCV(Т1−Т2). (6)
Отсюда видно, что при адиабатном расширении, когдаА=pΔV>0, газ охлаждается, т.е. ΔТ<0.
Если в формулу (6) подставить Т2 из уравнения адиабаты T1V1γ−1=T2V2γ−1, то получим ещё одно выражение для работы газа при адиабатном процессе:
А=νСVТ1(1−(V1/V2)γ−1) (получить самостоятельно).
Изопроцессы. Адиабатный процесс. Политропный процесс
1. Изотермический процесс. Изменение внутренней энергии при изотермическом процессе не происходит. Все количество теплоты, переданное системе, согласно формуле (48), идет на совершение работы: ΔQ=A.
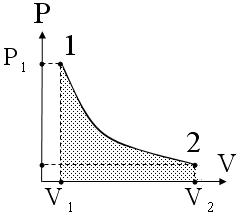
Рис. 12 Изотермический процесс (изотерма)
Полная работа A, совершаемая газом при изменении его объема от V1 до V2:
A= 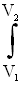 PdV=
PdV= 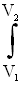 (m/M)·RT·dV/V=(mRT/M)·ln(V2/V1)=(mRT/M)·ln(P1/P2). (58)
(m/M)·RT·dV/V=(mRT/M)·ln(V2/V1)=(mRT/M)·ln(P1/P2). (58)
2. Изобарный процесс - процесс, протекающий при постоянном давлении. Первое начало термодинамики для изобарного процесса:

Рис. 13 Изобарный процесс (изобара)
ΔQ=Сv·(m/M)·RΔT+PΔV=Сp(m/M)ΔT. (59)
3. Изохорный процесс. При изохорном процессе газ не совершает работы. Первое начало термодинамики для изохорного процесса: ΔQ=ΔU.
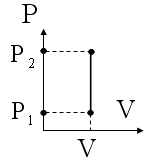
Рис. 14 Изохорный процесс (изохора)
Изменение внутренней энергии системы при изохорном процессе:
ΔU=mCvΔT/M (60)
4. Адиабатический процесс - процесс, при котором отсутствует теплообмен между системой и окружающей средой (ΔQ=0). Все быстропротекающие процессы можно отнести к адиабатическим.
Уравнения состояний системы для адиабатического процесса:
PVλ=const - уравнение Пуассона, (61)
TVλ-1=const, TλPλ-1=const.
Диаграмма адиабатического процесса (адиабата) в координатах (p,V) изображается более крутой гиперболой, чем изотерма (рис. 15). Это объясняется тем, что при адиабатическом сжатии увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры. Первое начало термодинамики для адиабатического процесса (внешняя работа совершается за счет изменения внутренней энергии системы):

Рис. 15. Адиабатный процесс (адиабата)
A=-ΔU, или PΔV=-mCvΔT/M. (62)
5. Политропический процесс – процесс, в котором теплоемкость остается постоянной:
PVn=const, (63)
где n - показатель политропы.
n=(C-Cp)/(C-Cv)
Из уравнения политропы получаются уравнения рассмотренных выше процессов:
Изобарный процесс: n=0, P=const.
Изотермический процесс: n=1, PV=const.
Адиабатный процесс: n=λ, PVλ=const.
Изохорный процесс: n=±∞, PVn=const.
Адиабатный процесс (в некоторых источниках упоминается как адиабатический) - это термодинамический процесс, который происходит при отсутствии теплообмена с окружающей средой. Есть несколько факторов, которые характеризуют этот класс. Например, адиабатный процесс происходит динамично и укладывается в короткий срок времени. Происходят процессы данного класса, как правило, мгновенно.
Адиабатный процесс. Формулы

·
·
·
·
·
Ранее была записана формула, выведенная из первого начала термодинамики. Используя ее, мы без особого труда можем вычислить работу в общем виде, которую будет выполнять газ при течении адиабатного процесса. Как вы уже могли догадаться, делать это мы будет при помощи интегрирования.
Итак, чтобы получить общую формулу работы для x молей газа, проинтегрируем выражение первого закона термодинамики для адиабатного процесса. Выглядеть все это будет следующим образом: A = - (интеграл) от dU. Раскроем это выражение, получим: A = - xCv (интеграл в пределах от T1 до T2) dT.
Теперь, когда мы привели интеграл к конечному виду, мы можем его упростить. На выходе получим формулу следующего вида: A = - xCv (T2 – T1). Ну и последним шагом станет небольшое упрощение. Избавимся от минуса перед формулой. Для этого сделаем в скобках небольшую перестановку, поменяв конечную температуру с начальной местами. В итоге получим: A = xCv (T1 – T2).
Яндекс.Директ
Уравнение адиабаты
Используя первое начало термодинамики для адиабатного процесса, мы можем найти уравнение адиабаты. При этом оно будет записано для произвольного числа молей идеального газа. Итак, запишем первоначальную формулу. Она имеет такой вид: dA + dU = 0. Но ведь мы прекрасно знаем, что работа идеального газа представляет численно собой не что иное, как произведение давления на изменение объема.
В то же время изменение внутренней энергии будет равно работе, взятой с обратным знаком. А ее-то мы уже нашли при помощи интегрирования. Значит, первое начало термодинамики для адиабатического процесса может принять следующий вид: pdV + xCvdT = 0. Из этого уравнения нам нужно исключить один показатель, а именно, температуру. Вернее, ее изменения. Чтобы сделать это, мы обратимся к достаточно часто используемому в молекулярной физики уравнению. А именно к уравнению Менделеева-Клапейрона.
Первичное выражение
Его нам нужно продифференцировать, чем мы и займемся. Итак, в общем виде уравнение выглядит следующим образом: PV = XRT. Вследствие дифференцирования оно будет приведено к такой форме: pdV + Vdp = xRdT. Отсюда мы можем выразить изменение энергии. Оно будет равно левой части, деленной на произведение количества вещества на универсальную газовую постоянную. Иными словами, формула будет такой: (pdV + Vdp)/xR. Остается только упростить ее. В итоге получим следующее выражение: dT = (pdV + Vdp)/x(Cp - Cv)
По сути дела, первая часть задачи выполнена. Остается только довести все до ума.
Примеры адиабатных процессов
·
·
·
·
·
Вскоре после того, как был открыт адиабатический процесс, стартовало огромное количество различных исследований. Так, была создана первая теоретическая модель, имеющая отношение к циклу Карно. Именно она позволила установить условные пределы, ограничивавшие развитие тепловых машин. Но в случае некоторых реальных процессов осуществлять цикл Карно достаточно трудно. Все дело в том, что в его состав входят изотермы. А они, в свою очередь, требуют задания определенной скорости термодинамических процессов.
Заключение
С целью обойти подобные проблемы был придуман цикл Отто, а также цикл сжижения газа. Они стали широко применяться при решении конкретных задач на практике. Стартовавшие исследования показали возможность описания некоторых природных процессов в адиабатическом плане, что позволило выявлять общие закономерности соответствующих процессов. Примером адиабатического процесса можно смело назвать химическую реакцию, которая происходит внутри некоторого объема газа, если система является замкнутой, а обмен с внешней средой теплом отсутствует.
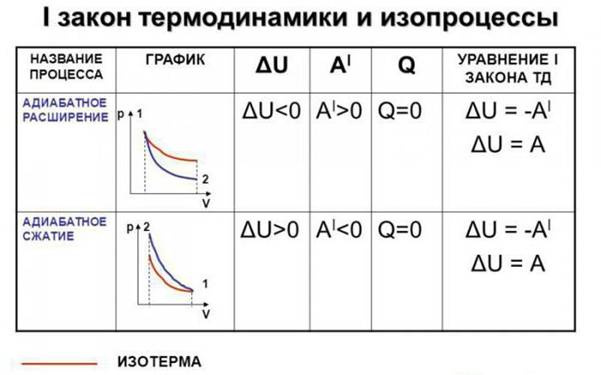
I начало термодинамики,
Q, U, A для изопроцессов
- Изотермический процессТ = const, m=const
Закон Бойля-Мариотта
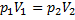 =const
=const 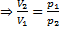
a)A= 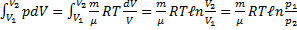
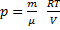
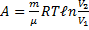
б) 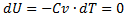
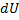 =0
=0
в ) 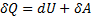
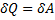
т.е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил
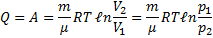
чтобы при работе расширения температура не изменялась, к газу в течение изобарного процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.
- Изобарический процесс. p=const m=const
- A=