Необратимая реакция первого порядка
Необратимая реакция первого порядка описывается уравнением, вытекающим из уравнения (9 - 7),
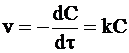 . (9 - 8)
. (9 - 8)
Уравнение (9 - 8) дополняется граничным условием:
в начальный момент времени (t = 0) концентрация вещества равна С0.
Разделив переменные и проинтегрировав уравнение (9 - 8), получим:
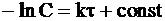 . (9 - 9)
. (9 - 9)
Подстановка граничных условий в уравнение (9 - 9) дает:
const = -lnC0,
а кинетическое уравнение для необратимой реакции первого порядка в интегральной форме принимает окончательный вид:
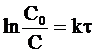 . (9 - 10)
. (9 - 10)
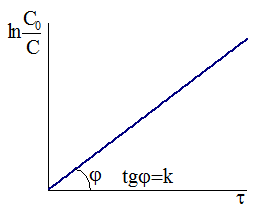 Рис. 9 - 1.Зависимость концентрации от времени для необратимой реакции первого порядка. Рис. 9 - 1.Зависимость концентрации от времени для необратимой реакции первого порядка. |
Таким образом, для необратимой реакции первого порядка существует прямая пропорциональность между логарифмом отношения исходной концентрации к действующей концентрации и временем протекания реакции (Рис. 9 ‑ 1).
Часто в качестве характеристики интенсивности протекания химической реакции вместо константы скорости используют время полупревращениявещества t1/2, то есть время, за которое концентрация вещества уменьшается вдвое (C = 1/2C0).
Радиоактивные превращения описываются таким же кинетическим уравнением, что и химические реакции первого порядка. Для них традиционно вместо времени полупревращения используют понятие время полураспада, которое также обозначается t1/2.
Подставляя данные, определяющие время полупревращения в уравнение (9 - 10), получим:
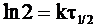
или
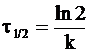 . (9 - 11)
. (9 - 11)
С учетом выражения (9 - 11) кинетическому уравнению реакции первого порядка можно придать следующую форму:
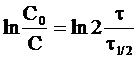 . (9 - 12)
. (9 - 12)
Кроме времени полупревращения, реакция может быть охарактеризована временем превращения вещества на X %, которое обозначим tХ%. В этом случае действующая концентрация должна быть равной:
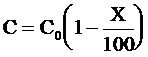 .
.
Следовательно,
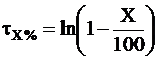 . (9 - 13)
. (9 - 13)
Если задачей кинетического исследования реакции ставится нахождение зависимости концентрации вещества от времени протекания реакции, то кинетическому уравнению придают следующий вид:
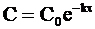 . (9 - 14)
. (9 - 14)
Уравнение (9 - 14) описывает кинетическую кривую, показанную на рис. 9 ‑ 2.
Для необратимой реакции, при которой не образуются промежуточные вещества, концентрация продукта реакции CB определяется из условия:
C0 = C + CB.
Поэтому кинетика накопления продукта реакции описывается кинетическим уравнением:
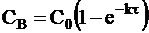 . (9 - 15)
. (9 - 15)
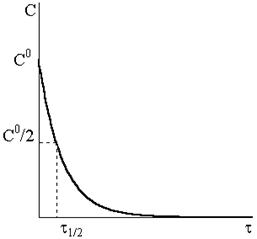 Рис. 9 - 2.Кинетическая кривая реакции первого порядка. Рис. 9 - 2.Кинетическая кривая реакции первого порядка. |
Кинетическая кривая расходования исходного вещества и кривая накопления продуктов реакции пересекаются в точке, отвечающей времени полупревращения.
Еще одной характеристикой необратимой реакции первого порядка служит среднее время жизни молекулы 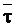 . В соответствии с определением средней величины можно воспользоваться уравнением:
. В соответствии с определением средней величины можно воспользоваться уравнением:
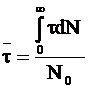 , (9 - 16)
, (9 - 16)
где t - время жизни молекул, число которых соответствует интервалу от N до N + dN, N0 - общее число молекул, принимающих участие в реакции.
В соответствии с уравнением (9 - 8) число молекул с заданным временем жизни t можно определить, используя равенство
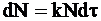 , (9 - 17)
, (9 - 17)
а из уравнения (9 - 14) следует:
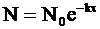 .
.
Уравнение для расчета среднего времени жизни молекулы принимает следующий вид:
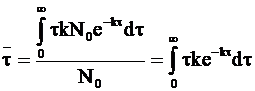 . (9 - 18)
. (9 - 18)
Уравнение (9 - 18) интегрируется по частям, для чего можно обозначить u = t, 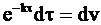 :
:
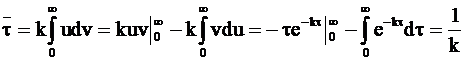 . (9 - 19)
. (9 - 19)
Ниже приводится соотношение между характеристиками необратимой реакции первого порядка:
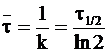 . (9 - 20)
. (9 - 20)
