ЭДС гальванического элемента, состоящего из медного и цинкового электродов, погруженных в 0,01 М растворы их сульфатов
(Е0Сu2+/Cu=0,34B, Е0Zn2+/Zn=-0,76B) равна___В.
1) 1,10
2) 0,70
3) 0.28
4) 0,43
8) Для вычисления потенциала серебряного электрода в разбавленном растворе серебра с концентрацией CAg+ моль/л используется формула…
1) 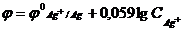
2) 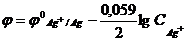
3) 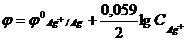
4) 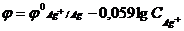
9) Для защиты медных изделий от коррозии в качестве катодного покрытия можно использовать…
1) Sn
2) Ag
3) Cr
4) Ni
10) При частичном восстановлении Сr2O3 образуется…
1) СrO
2) СrO2 -
3) СrO4 2-
4) Сr2O7 2-
11) Если при электролизе водного раствора соли значение рН в катодном пространстве возросло, то электролизу подвергался раствор…
1) Cu(NO3)2
2) KCl
3) CuCl2
4) ZnCl2
12) Эквивалент перманганата калия, если ион MnO4- восстанавливается до Mn+2,равен___ моль
1) 1/3
2) 1/4
3) 1/5
4) 1/2
13) При электролизе раствора, содержащего одинаковые концентрации солей, на катоде в первую очередь будет выделятся…
1) железо
2) свинец
3) серебро
4) медь
14) В реакции 3Ca + 2P®Ca3P2 атомы фосфора выступают в качестве…
1) окислителей и восстановителей одновременно
2) доноров неподелённой электронной пары
3)окислителей
4) восстановителей
15) Сумма коэффициентов в уравнении реакции, соответствующая схеме 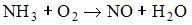 , составляет …
, составляет …
1) 20
2) 19
3) 21
4) 18
16) В гальваническом элементе, состоящем из никелевого 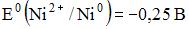 и железного
и железного 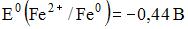 электродов, погруженных в 1 М растворы их солей, на аноде протекает процесс …
электродов, погруженных в 1 М растворы их солей, на аноде протекает процесс …
1) 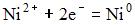
2) 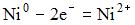
3) Fe 0 - 2e = Fe2+
4) 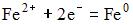
17) Уравнение, которое описывает процесс электролиза расплава хлорида натрия в инертной атмосфере, имеет вид …
1) 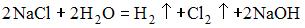
2) 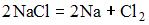
3) 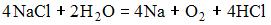
4) 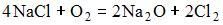
18) Сумма коэффициентов в суммарном уравнении процесса электролиза водного раствора AgNO3 равна…
1) 11
2) 15
3) 3
4) 7
19) При электролизе раствора хлорида меди (II) на катоде выделилось 2,7 г меди. Объем газа (н.у.), выделившегося на аноде равен _______ л.
1) 4,48
2) 8,96
3) 2,24
4) 6,72
20) При окислении в нейтральной среде KMnO4 восстанавливается с образованием…
1) Mn+2
2) Mn
3) K2MnO4
4) MnO2
21) Уравнение процесса, протекающего на катоде при электролизе водного раствора КОН, имеет вид…
1) 2 Н+ + 2 ē ® Н2
2) 2 Н2О -4 ē ® 4 Н+ + О2
3) 2 Н2О + 2 ē ® Н2 + 2 ОН-
4) К+ + ē ® К0
22) Сумма коэффициентов в левой части уравнения реакции KMnO4 + Na2SO3 + H2SO4®… составляет…
1) 6
2) 8
3) 12
4) 10
23) При прохождении через раствор нитрата серебра количества электричества величиной 48250Кл на катоде образуется ___граммов чистого серебра (F=96500Кл/моль).
1) 27
2) 54
3) 18
4) 108
24) Коэффициент перед молекулой восстановителя в уравнении реакции KMnO4 + Na2SO3 + H2SO4 = MnSO4 + Na2SO4 + K2SO4 + H2O равен.
1) 5
2) 3
3) 2
4) 1
25) Уравнение процесса, протекающего на инертном аноде при электролизе водного раствора хлорида натрия, имеет вид…
1) 2 Н2О - 4ē = О2 + 4 Н+
2) 4 ОН¯ - 4ē = 4 ОН¯
3) 2 Cl¯ - 2ē = Cl2
4) O2 + 2 H2O +4ē = 4OH¯
26) При зарядке свинцового аккумулятора на аноде протекает процесс…
1) Pb +SO42- ® PbSO4 + 2ē
2) PbO2 + 4H+ + SO42- + 2ē ® PbSO4 + 2H2O
3) PbSO4 + 2H2O ® PbO2 + 4H+ + SO42- + 2ē
4) PbSO4 + 2ē ® Pb +SO42-
27) Окисление азота происходит в процессе, схема которого…
1) NO2¯ ® NO
2) NH4+ ® N2
3) NO3¯ ® NO
4) Li3N ® NH3
28) Н2S обычно проявляет в окислительно-восстановительных реакциях свойства…
1) Только окислителя
2) Только восстановителя
3) И окислителя, и восстановителя
4) Ни окислителя, ни восстановителя
29) Если гальванический элемент составлен из двух серебряных электродов, один из которых стандартный, то для достижения наибольшего ЭДС другой электрод следует погрузить в раствор AgNO3 c концентрацией
1) 0,5 М
2) 0,2 М
3) 0,4 М
4) 0,1 М
30) Металлом, который нельзя получить электролизом водного раствора его соли, является…
1) Ag
2) Na
3) Ni
4) Cu
31) ЭДС гальванического элемента состоящего из железного и серебрянного электродов, погруженных в 0,1 М растворы их нитратов Е0(Fe+2/ Fe)= -0,44 В, Е0(Ag+/ Ag)= 0,80 В, равна_______В.
1) 1,21
2) 1,24
3) – 1,21
4) – 1,24
32) Чтобы получить анодное защитное покрытие, на железо следует нанести слой…
1) Хром
2) Олово
3) Никель
4) Свинец
33) Для получения 54 г серебра электролизом водного раствора нитрата серебра (выход по току 100%), необходимо чтобы в растворе содержалось___граммов чистой соли
1) 255
2) 85
3) 340
4) 170
34) При электролизе водного раствора КСl на инертном аноде выделяется…
1) К
2) Н2
3) О2
4) Сl2
В реакции
K2Cr2O7 +6KI +7H2SO4=Cr2(SO4)3 + 4K2SO4 +3I2 +7H2O
восстанавливается ион…
1) Н+
2) Сr2O72-
3) I-
4) SO42-
36) При электролизе водного раствора СuCl2 с графитовым анодом на …
1) катоде выделяется водород
2) аноде выделяется кислород
3) аноде выделяется хлор
4) катоде выделяется хлор
37) Oкислительно-восстановительная реакция в стандартных условиях возможна, если…
1) электроотрицательность окислителя выше электроотрицательсности восстановителя
2) стандартный потенциал Е0 восстановителя имеет отрицательное значение
3) значение разности потенциалов полуреакций окисления и восстановления положительно
4) стандартный потенциал Е0 окислителя имеет положительное значение
38) Согласно схеме гальванического элемента Fe|Fe2+||Ni2+|Ni ,…
1) электроны движутся от железного электрода к никелевому
2) никель окисляется
3) никелевый электрод является анодом
4) в процессе работы элемента на электроде осаждается железо
39) В системе, состоящей из луженого (покрытого оловом) железа при нарушении целостности покрытия в морской воде самопроизвольно протекает…
1) восстановление олова
2) окисление олова
3) восстановление железа
4) окисление железа
40) При электролизе водного раствора хлорида натрия на катоде протекает реакция…
1) 2H2O –4e → O2+4H+
2) 2H2O +2e → H2+2OH-
3) Na+ +e→Na
4) 2H++2e→H2
41) При электролизе воды на аноде выделилось 11,2 л (н.у.) кислорода. Объем водорода, выделившегося на катоде равен ____ л (н.у.)
1)22.4
2) 5.6
3) 44.8
4) 11.2
